Lietuvos chirurgija ISSN 1392–0995 eISSN 1648–9942
2020, vol. 19(1–2), pp. 12–19 DOI: https://doi.org/10.15388/LietChirur.2020.19.20
Sarkopenija – skrandžio vėžio chirurgijoje neįvertintas rizikos veiksnys
Martynas Lukšta
Gastroenterologijos, nefrourologijos ir chirurgijos klinika, Klinikinės medicinos institutas, Medicinos fakultetas, Vilniaus universitetas, Lietuva
Clinic of Gastroenterology, Nephrourology and Surgery, Institute of Clinical Medicine, Faculty of Medicine, Vilnius University, Lithuania
El. paštas lukstamartynas@gmail.com
Raminta Lukšaitė-Lukštė
Gastroenterologijos, nefrourologijos ir chirurgijos klinika, Klinikinės medicinos institutas, Medicinos fakultetas, Vilniaus universitetas, Lietuva
Clinic of Gastroenterology, Nephrourology and Surgery, Institute of Clinical Medicine, Faculty of Medicine, Vilnius University, Lithuania
El. paštas raminta.luksaite@santa.lt
Augustinas Baušys
Gastroenterologijos, nefrourologijos ir chirurgijos klinika, Klinikinės medicinos institutas, Medicinos fakultetas, Vilniaus universitetas, Lietuva
Clinic of Gastroenterology, Nephrourology and Surgery, Institute of Clinical Medicine, Faculty of Medicine, Vilnius University, Lithuania
El. paštas abpelikanas@gmail.com
Kęstutis Strupas
Gastroenterologijos, nefrourologijos ir chirurgijos klinika, Klinikinės medicinos institutas, Medicinos fakultetas, Vilniaus universitetas, Lietuva
Clinic of Gastroenterology, Nephrourology and Surgery, Institute of Clinical Medicine, Faculty of Medicine, Vilnius University, Lithuania
El. paštas kestutis.strupas@santa.lt
Santrauka. Chirurgija yra pagrindinis skrandžio vėžio gydymo metodas, leidžiantis tikėtis visiško pasveikimo. Operacijos dėl skrandžio vėžio yra didelės apimties, jos susijusios su didele pooperacinių komplikacijų rizika. Maždaug pusei sergančiųjų skrandžio vėžiu nustatoma sarkopenija. Tai reikšmingas pooperacinių komplikacijų rizikos veiksnys, lemiantis prastesnius atokiuosius gydymo rezultatus.
Sarkopenija vis dar yra tik klinikinių tyrimų objektas, šiandienos rutininėje klinikinėje praktikoje ji nevertinama. Sarkopenijos diagnostika apima tyrimus, kuriais siekiama nustatyti raumenų jėgą, masę ir kokybę, tačiau diagnostikos metodika nėra galutinai standartizuota. Diagnostikai taikomi plaštakos griebimo jėgos, „sėsti – stoti“ testo, kompiuterinės tomografijos, magnetinio rezonanso, ultragarso, bioimpedanso ir densitometrijos tyrimai.
Sarkopenijos reikšmė skrandžio vėžiui gydyti vis labiau auga. Tikėtina, kad netolimoje ateityje sarkopenijos vertinimas ir gydymas taps kasdienės klinikinės praktikos dalimi. Taigi tikslinga atlikti papildomus klinikinius tyrimus, kurie padėtų standartizuoti diagnostiką ir rasti efektyvius gydymo metodus.
Reikšminiai žodžiai: sarkopenija, onkologinė chirurgija, skrandžio vėžys.
Underestimated Value of Sarcopenia in Gastric Cancer Surgery
Abstract. Surgery remains the only potentially curative option for gastric cancer, although it is related to high postoperative morbidity and mortality rate. Approximately every second gastric cancer patient is diagnosed with sarcopenia, which is a significant risk factor for postoperative complications and poor long-term outcomes. However, sarcopenia is underestimated in routine clinical practice, since it remains the interest of clinical trials. Sarcopenia diagnostic criteria are not fully standardized, but it consists of tests for muscle strength, quantity and quality. They include grip strength, chair stand test, computed tomography, magnetic resonance imaging, ultrasound, bioelectrical impedance analysis and densitometry tests. Regarding the growing evidence for sarcopenia impact on surgical gastric cancer treatment results, it is a high probability that sarcopenia assessment will come to routine clinical practice. Although, until then there is a need for further clinical trials to standardize the diagnostic and to find effective treatment strategies.
Key words: sarcopenia, surgical oncology, gastric cancer.
Received: 2020/01/05. Accepted: 2020/04/01.
Copyright © 2020 Martynas Lukšta, Raminta Lukšaitė-Lukštė, Augustinas Baušys, Kęstutis Strupas. Published by Vilnius University Press. This is an Open Access article distributed under the terms of the Creative Commons Attribution Licence, which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Sarkopenija ir skrandžio vėžys
Skrandžio vėžys – aktuali onkologijos problema. Tai trečia pagal dažnumą mirties nuo vėžio priežastis pasaulyje ir penkta pagal dažnumą pasaulyje diagnozuojama onkologinė liga [1]. Chirurginis gydymas yra vienintelis šios ligos gydymo metodas, leidžiantis tikėtis visiško pasveikimo. Nors pastaraisiais metais reikšmingai ir gana sparčiai plėtojama tiek anesteziologija, tiek operacinė technika, tiek pooperacinė pacientų priežiūra, skrandžio vėžio chirurgija išlieka susijusi su didele pooperacinių komplikacijų rizika ir pooperaciniu mirštamumu [2]. Pooperacinių komplikacijų patiria net iki 46 proc. pacientų, o apie 5 proc. pacientų miršta per pirmąsias 30 dienų po operacijos [3, 4].
Pooperacinių komplikacijų rizikos veiksniai įprastai skirstomi į dvi grupes: veiksnius, susijusius su individualiomis paciento savybėmis, ir veiksnius, susijusius su chirurginės technikos ar pagrindinės ligos ypatumais. Su pacientu susiję rizikos veiksniai: 1) vyresnis amžius (daugumoje studijų nurodoma, jog vyresni negu 65 m. pacientai skirtini didelės rizikos grupei) [5, 6]; 2) gretutinės ligos (ypač kai sergama daugiau negu viena liga, pavyzdžiui, kardiovaskuline liga, cukriniu diabetu ar inkstų funkcijos nepakankamumu) [5–7]; 3) nutukimas [8]; 4) priešoperacinis mitybos nepakankamumas [9]; 5) rūkymas [10]. Su operacine technika ar liga susiję rizikos veiksniai: totalinė gastrektomija, kraujo transfuzijų poreikis, multiorganinė rezekcija, pažengusi naviko stadija [9, 11, 12]. Pastaruoju metu mokslinėje literatūroje vis dažniau minima ir sarkopenija – dar vienas su pacientu susijęs, tačiau šiandienos klinikinėje praktikoje rutiniškai nenustatomas rizikos veiksnys, lemiantis nepalankius chirurginius rezultatus [13–17]. Pacientų, kuriems nustatoma sarkopenija, komplikacijų rizika gali padidėti net keletą kartų [13–17].
Istoriškai sarkopenija apibrėžiama kaip raumenų masės sumažėjimas. Toks apibrėžimas kai kuriuose mokslo darbuose pateikiamas ir šiandien [18]. Vis dėlto tiksliau sarkopeniją apibrėžti kaip progresuojantį ir generalizuotą skeleto raumenų sutrikimą, apimantį ne tik raumenų masės sumažėjimą, bet ir – tai svarbiausia – raumenų funkcijos praradimą [19]. Sarkopenija tampa vis reikšmingesnė skrandžio vėžio gydymo rezultatams. Ji siejama ne tik su išaugusiu pooperacinių komplikacijų dažniu, bet ir su blogesniais atokiaisiais gydymo rezultatais [1, 20, 21]. Sarkopenijos reikšmė prognozuojant skrandžio vėžio gydymo rezultatus vis akivaizdesnė, todėl šio sindromo nustatymas prieš pradedant pacientą gydyti turi potencialo tapti rutinine klinikinės praktikos dalimi. Tai leistų kiekvienam pacientui parinkti individualiai jam tinkamiausią gydymą. Sarkopenijos nustatymo galimą svarbą dar labiau pabrėžia faktas, jog ji yra potencialiai modifikuojamas rizikos veiksnys.
Šiame straipsnyje apžvelgsime šiandieninius sarkopenijos diagnostikos ir modifikavimo būdus.
Sarkopenijos paplitimas ir šiuolaikinė diagnostika
Sarkopenija yra progresuojanti raumenų masės ir funkcijos netektis. Šio sindromo paplitimas susijęs su vyresniu amžiumi. Bendrojoje populiacijoje tarp 60–70 m. amžiaus asmenų sarkopenijos dažnis siekia 5–13 proc., o vyresnių negu 80 m. asmenų grupėje gali viršyti net 50 proc. [19]. Remiantis naujausiais Lietuvos vėžio registro duomenimis, dauguma sergančiųjų skrandžio vėžiu yra 60 m. ir vyresni asmenys. Minėtina, kad sarkopenijos paplitimo dažnis sergančiųjų skrandžio vėžiu grupėje (36–58 %) yra didesnis negu bendrojoje populiacijoje [2, 21, 22].
Lietuvoje pastebimas vidutinės tikėtinos gyvenimo trukmės ilgėjimas. Senstant visuomenei, tenka gydyti vis daugiau vyresnio amžiaus pacientų, sergančių skrandžio vėžiu. Galima daryti prielaidą, kad ateityje skrandžio vėžiu sergančių pacientų, kuriems nustatoma sarkopenija, daugės.
Pastaraisiais metais tiek klinicistų, tiek mokslininkų dėmesys sarkopenijos problemai auga, tačiau vis dar nėra aiškių rekomendacijų, kaip ir kokiais testais remiantis nustatyti ir pamatuoti sarkopenijos lygį ir įvertinti, ar esanti sarkopenija yra kliniškai reikšminga. Siekiant nustatyti sarkopeniją, siūloma pradėti nuo anamnestinės apklausos ir ieškoti tipiškų simptomų. Tai: jėgos susilpnėjimas, kritimai, sulėtėjęs vaikščiojimas, sunkumai atsikeliant nuo kėdės ar sunkumai atliekant buities darbus, kai reikia kelti daiktus ar būtina kita fizinė veikla [23]. Esant kuriam nors iš išvardytų simptomų, pacientą tikslinga tirti toliau.
Europos vyresnio amžiaus žmonių sarkopenijos darbo grupė (EWGSOP) siūlo naudoti standartizuotą SARC-F klausimyną. Šis penkių klausimų klausimynas gali pasitarnauti kaip įrankis, identifikuojant pacientus, turinčius reikšmingą sarkopenijos riziką [24]. Vėliau, norint diagnozuoti sarkopeniją, reikia atlikti objektyvius testus raumenų jėgai nustatyti ir raumenų masės sumažėjimui bei fizinei būklei įvertinti [25]. EWGSOP siūlomas sarkopenijos algoritmas pavaizduotas 1 pav. [25].
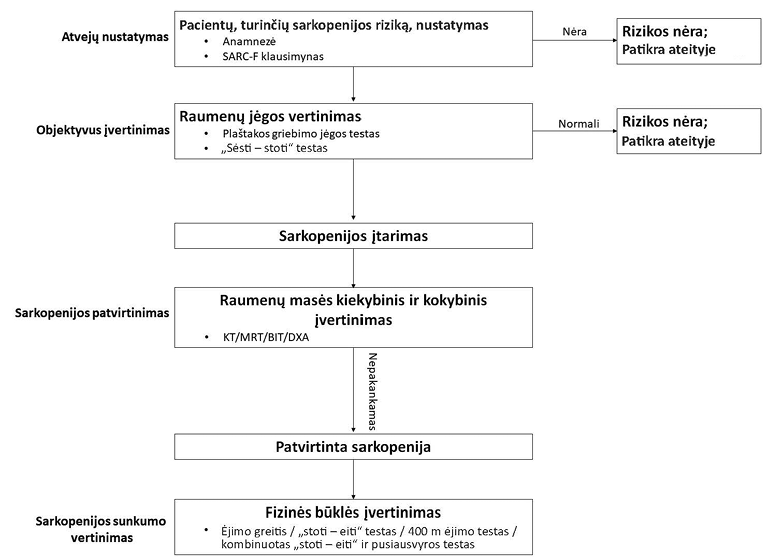
KT – kompiuterinė tomografija, MRT – magnetinio rezonanso tyrimas, BIT – bioimpedanso tyrimas, DXA – densitometrijos tyrimas
1 pav. Europos vyresnio amžiaus žmonių sarkopenijos darbo grupės (EWGSOP) siūlomas sarkopenijos diagnostikos algoritmas [25]
Tyrimai raumenų jėgai vertinti
Siekiant nustatyti sarkopeniją, įprasta taikyti keletą skirtingų testų, kuriais vertinama atskirų raumenų grupių jėga.
Viršutinių galūnių jėga gali būti vertinama naudojant plaštakos griebimo testą. Šis testas yra paprastas ir pigus, nes jam atlikti reikia tik dinamometro. Testo rezultatai koreliuoja su sudėtingesniais viršutinės ar apatinės galūnės jėgos vertinimo testų rezultatais, todėl plaštakos griebimo jėgos testas plačiai naudojamas klinikinėje praktikoje [25].
Apatinės galūnės jėgai vertinti dažnai naudojamas „sėsti – stoti“ testas. Tiriamojo prašoma penkis kartus atsistoti nuo kėdės nenaudojant rankų, tuo metu matuojama testo įvykdymo trukmė. Alternatyviai galimas panašus testas, kai tiriamojo prašoma kuo daugiau kartų atsistoti nuo kedės per 30 sekundžių [25].
Egzistuoja daug kitų testų, kurie leidžia įvertinti įvairių kūno raumenų grupių jėgą, tačiau aprašytieji yra plačiausiai paplitę dėl metodo paprastumo.
Tyrimai raumenų masei ir kokybei vertinti
Raumenų masei ir kokybei išmatuoti gali būti naudojami įvairūs radiologiniai tyrimai: kompiuterinė tomografija (KT), magnetinio rezonanso tomografijos (MRT), densitometrijos (DXA), ultragarso (UG) tyrimai.
Patogiausias ir šiuo metu dažniausiai naudojamas tyrimas raumenų masei nustatyti yra KT. Ji gali būti laikoma „auksiniu standartu“ [26]. KT tyrimas gali tiksliai diferencijuoti raumeninį ir riebalinį audinį ir pateikti tikslią anatominę informaciją [26]. Šis dviejų audinių atskyrimas yra ypač reikšmingas vertinant riebalų depozitą raumenyse, žinomą kaip miosteatozė (angl. myosteatosis). Teoriškai, naudojant KT tyrimą, galima matuoti bet kurių kūno raumenų tūrį ir masę, tačiau šiandienos standartu laikoma Musculus psoas ploto matavimas L3 stuburo slankstelio lygmenyje [27] (2 pav.). Šio vieno raumens (o ne atskirų raumenų grupių ar bendro raumenų tūrio) matavimas yra patogus ir greitas būdas raumeniniam plotui vertinti, o mažas M. psoas raumens plotas yra patikimas neigiamas predikcinis veiksnys sergančiųjų onkologinėmis ligomis klinikinėms išeitims [27–29].
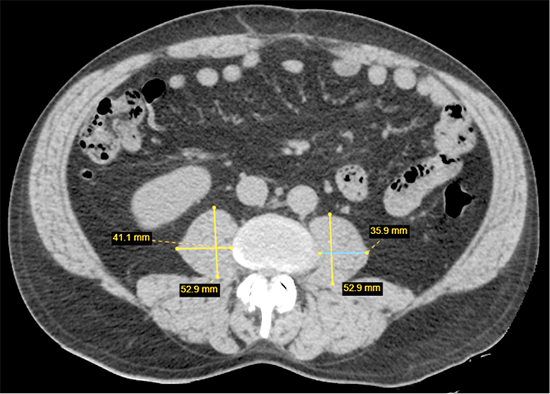
2 pav. Musculus psoas ploto matavimas L3 stuburo slankstelio lygyje, atliekant KT
Minėtinas dar vienas KT tyrimo sarkopenijai vertinti privalumas – šis tyrimas yra neinvazinis. Be to, sergantiesiems skrandžio vėžiu viso kūno KT atliekamas rutiniškai nustatant ligos stadiją ir stebint pacientą dėl ligos recidyvo po operacijos. Minėto tyrimo taikymas būtų itin tinkamas pacientų, sergančių skrandžio vėžiu, sarkopenijai vertinti. Nereikėtų atlikti papildomo tyrimo, būtų galima tik papildomai įvertinti parametrus jau esančiuose vaizduose. Kalbamuoju atveju taptų nereikšmingi minimi KT trūkumai – kaina ar radiacinė apšvita, nes KT tyrimas jau yra standartinės klinikinės praktikos dalis.
Raumenų tūris taip pat gali būti vertinamas atliekant MRT tyrimą. Taikant MRT, gerai vizualizuojama edema, uždegimas, miosteatozė, raumenų fibroziniai ir atrofiniai pakitimai [26]. Palyginti su KT, MRT tyrimo privalumas – išvengiama radiacinės apšvitos. Vis dėlto šis tyrimas yra brangesnis, jį atlikti užtrunka ilgiau, o tyrimo prieinamumas yra daug mažesnis negu KT. Dėl šių priežasčių MRT tyrimas naudojamas sarkopenijai vertinti, kai reikalingas ilgalaikis pacientų stebėjimas, tyrimus reikia atlikti dažnai ar kai MRT reikalauja klinikinė situacija.
DXA privalumai – sąlygiškai maža apšvita ir mažesnė negu KT kaina. Vis dėlto DXA stokoja tikslumo vertinant liemens riebalus ir raumenis, nes matavimus dažnai iškreipia pilvo organai [26]. Todėl, vertinant sarkopeniją DXA metodu, dažniau renkamasi vertinti raumenų masę galūnėse, o tai ne visuomet tiksliai atspindi bendrąjį sarkopenijos lygį. DXA tyrimas gali būti laikomas labai patraukliu atliekant sarkopenijos vertinimą bendrojoje populiacijoje, tačiau tiriant pacientus, sergančius skrandžio vėžiu, dėl anksčiau minėtų priežasčių pirmenybė turėtų būti teikiama KT.
Kai kuriais atvejais vertinant raumenų masę sarkopenijai nustatyti galima pasitelkti UG tyrimą. Šis tyrimas yra plačiai prieinamas, greitas, pigus, neinvazinis, jį atliekant negaunama radiacinės apšvitos. Tyrimas tinka ne tik sergančiųjų, bet ir vaikų ar nėščiųjų raumenų masei vertinti. Vis dėlto UG tyrimas yra subjektyvus – jis labai priklauso nuo tiriančiojo ir yra tinkamesnis galūnių raumenims, o ne giliesiems kūno raumenims vertinti, ypač tiriant nutukusius asmenis.
Be radiologinių tyrimų, raumenų masei matuoti galima pasitelkti bioimpedanso tyrimą (BIT). Šiuo tyrimu raumenų tūris tiesiogiai nematuojamas – jis apskaičiuojamas remiantis kūno elektriniu laidumu. Įranga šiam tyrimui atlikti yra sąlygiškai nebrangi, ją lengva tiek transportuoti, tiek naudoti. Vis tik taikant BIT gauti rezultatai ne visada yra tikslūs, jie labai priklauso nuo paciento kūno hidratacijos, kurią gali lemti ne tik išgertų skysčių kiekis, bet ir gretutinės inkstų ar širdies sistemos ligos [30]. Dėl šių priežasčių sunku standartizuoti BIT, siekiant rezultatų tikslumo. Minėtas tyrimas yra daug žadantis, tačiau reikia atlikti daugiau specifinių populiacijų klinikinių tyrimų, kad BIT galėtų būti laikomas „auksiniu standartu“ [25]. Minėtina ir tai, kad kalbamojo tyrimo naudojimą riboja paciento turimi metaliniai ar elektriniai implantai [30].
Tyrimai fizinei būklei vertinti
EWGSOP gairėse siūloma vertinti pacientų fizinę būklę – siekiama įvertinti ne tik raumenų jėgą, bet ir funkciją, kuriai atlikti reikalingas tiek raumuo, tiek tinkama centrinės ir periferinės nervų sistemos veikla. Rekomendacijose siūloma naudoti nesudėtingus testus, kuriais galima vertinti izoliuotą pacientų ėjimo greitį, ar kombinuotuosius testus. Kombinuotuosiuose testuose ėjimo greitis vertinamas kartu su gebėjimu atsistoti nuo kėdės ir grįžti atgal, papildomai vertinama paciento pusiausvyra. Atliekant šiuos testus diferencijuojama tarp lengvo ir sunkaus sarkopenijos laipsnio. Vienas iš tokių testų pavyzdžių – matuojamas ėjimo greitis, tiriamajam einant 4 metrų ilgio atkarpą. Testo įvertį ≤0,8 m/s rekomenduojama laikyti sunkios sarkopenijos požymiu [25].
Sarkopenijos etiopatogenezė ir modifikavimas
Sarkopenijos etiopatogenezė yra daugiaveiksnė (žr. 3 pav.). Šiai patologijai atsirasti ir progresuoti reikšmingos būklės, susijusios su mažu raumenų aktyvumu (pvz.: sėslus gyvenimo būdas; imobilizacija; būklės, lemiančios dažną poreikį ilsėtis gulint), gretutinės ligos, per mechanizmus susijusios su lėtiniu uždegimu ar metabolizmo sutrikimais (endokrininės, onkologinės, lėtinės uždegiminės ar organų nepakankamumą sukeliančios ligos) [31], ir mitybos nepakankamumas, darantis reikšmingą įtaką miocitų homeostazei ir energijos apykaitai [31].
Medikamentinis gydymas sarkopenijai gydyti šiandien dar nėra patvirtintas. Ankstyvieji įrodymai rodo, kad gali būti naudingos medžiagos, veikiančios kaip miostatino inhibitoriai [32]. Miostatinas – natūralus raumenų augimo inhibitorius, stabdantis raumenų ląstelių diferenciaciją, hipertrofiją ir baltymų sintezę. II fazės tyrimo rezultatai atskleidžia, kad antikūnų panaudojimas prieš miostatiną gali būti susijęs su raumenų masės ir funkcinių rezultatų pagerėjimu senyvų asmenų, turinčių žemą raumenų jėgą, populiacijoje. Vis dėlto tai tik ankstyvieji tyrimų etapai ir sunku prognozuoti, ar minėti preparatai bus efektyvūs sarkopenijai modifikuoti didesnės apimties klinikiniuose tyrimuose.
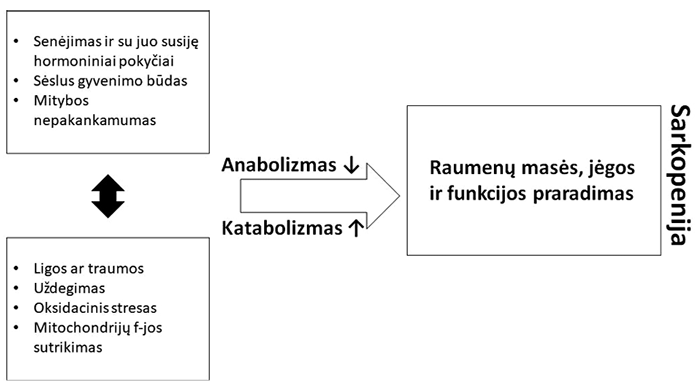
3 pav. Etiopatogenetiniai sarkopenijos veiksniai
Atsižvelgiant į sarkopenijos etiopatogenezę, pagrindinis šiuo metu rekomenduojamas gydymas – fizinio aktyvumo didinimas ir mitybos korekcija [31]. Specifiniai fiziniai pratimai didina raumenų jėgą ir masę, o aerobinės treniruotės – jautrumą insulinui [33]. Siekiant geresnių sarkopenijos gydymo rezultatų, kartu su fiziniais pratimais siūloma derinti mitybinę terapiją [31]. Deja, nepaisant gausių tyrimų, nurodančių fizinės veiklos ir mitybinės terapijos naudą, vis dar trūksta šių metodų standartizavimo. Iki galo nėra aišku, koks fizinių pratimų ir dietos protokolas yra efektyviausias.
Paciento fizinės veiklos didinimas ir mitybinė terapija yra naujos paciento paruošimo operacijai strategijos – priešoperacinės reabilitacijos sudedamosios dalys. Manoma, kad priešoperacinė reabilitacija pagerina pacientų fizinę būklę, jų gyvenimo kokybę ir reikšmingai sumažina pooperacinių komplikacijų dažnį [34].
Priešoperacinė paciento paruošimo operacijai strategija dažniausiai yra klinikinių tyrimų, o ne kasdienės praktikos dalis. Priešoperacinei pacientų reabilitacijai ir sarkopenijai gydyti taikomos labai panašios intervencijos, todėl galima kelti hipotezę, kad sarkopeniją galima modifikuoti dar ikioperaciniu periodu, kai pacientui taikoma priešoperacinės reabilitacijos programa. Vis tik priešoperacinės reabilitacijos programos dažniausiai yra trumpos, nes negalima ilgesniam laikui atidėti operacijos. Nėra aišku, ar intensyvi trumpa intervencija, didinant paciento fizinį aktyvumą ir taikant mitybinę terapiją, būtų pakankamos apimties sarkopenijai modifikuoti.
Pastaraisiais metais daugėja duomenų apie priešoperacinę reabilitaciją ir jos galimą naudą chirurginiams pacientams, tačiau nėra atlikta klinikinių tyrimų, kuriais būtų įvertinta, ar taikytina intervencija galėtų lemti sergančiųjų skrandžio vėžiu sarkopeniją. Lietuvoje, Vilniaus universitete, 2020 m. pradedamas vykdyti klinikinis tyrimas „Personalizuotos priešoperacinės reabilitacijos reikšmė pacientų, sergančių skrandžio vėžiu, gydyme“. Šio tyrimo metu tikimasi įvertinti, ar priešoperacinė reabilitacija gali turėti įtakos pacientų, sergančių skrandžio vėžiu, sarkopenijai.
Išvados
Daugėja duomenų, jog sarkopenija yra reikšmingas rizikos veiksnys skrandžio vėžio chirurgijoje, lemiantis pooperacines komplikacijas ir blogesnius atokiuosius gydymo rezultatus. Šiuo metu sarkopenijos vertinimas nėra kasdienės klinikinės praktikos dalis, tačiau jau netolimoje ateityje gali ja tapti.
Sarkopeniją galima modifikuoti pasitelkiant fizinius pratimus ir mitybinę terapiją, tačiau iki šiol nėra šio gydymo standartizacijos. Į paciento fizinio aktyvumo didinimą ir mitybinę terapiją orientuojama ir priešoperacinė reabilitacija, todėl tikslingi nauji biomedicininiai tyrimai, įvertinantys, ar sarkopenija gali būti modifikuojama, pacientus įtraukiant į priešoperacinės reabilitacijos programas.
Literatūra
1. Kamarajah SK, Bundred J, Tan BHL. Body composition assessment and sarcopenia in patients with gastric cancer: a systematic review and meta-analysis. Gastric Cancer 2019; 22(1): 10–22.
2. O’Brien S, Twomey M, Moloney F, Kavanagh RG, Carey BW, Power D, Maher MM, O’Connor OJ, Ó’Súilleabháin C. Sarcopenia and Post-Operative Morbidity and Mortality in Patients with Gastric Cancer. J Gastric Cancer 2018; 18(3): 242–252.
3. Norero E, Vega EA, Diaz C, Cavada G, Ceroni M, Martínez C, Briceño E, Araos F, Gonzalez P, Baez S, Vinuela E, Caracci M, Diaz A. Improvement in postoperative mortality in elective gastrectomy for gastric cancer: Analysis of predictive factors in 1066 patients from a single centre. Eur J Surg Oncol 2017; 43(7): 1330–1336.
4. Kanda M. Preoperative predictors of postoperative complications after gastric cancer resection. Surg Today 2020; 50(1): 3–11.
5. Kim HS, Kim MG, Kim BS, Lee IS, Lee S, Yook JH, Kim BS. Analysis of predictive risk factors for postoperative complications of laparoscopy-assisted distal gastrectomy. J Laparoendosc Adv Surg Tech A. 2013; 23(5): 425–430.
6. Nevo Y, Goldes Y, Barda L, Nadler R, Gutman M, Nevler A. Risk Factors for Complications of Total/Subtotal Gastrectomy for Gastric Cancer: Prospectively Collected, Based on the Clavien-Dindo Classification System. Isr Med Assoc J IMAJ 2018; 20(5): 277–280.
7. Hamakawa T, Kurokawa Y, Mikami J, Miyazaki Y, Takahashi T, Yamasaki M, Miyata H, Nakajima K, Takiguchi S, Mori M, Doki Y. Risk factors for postoperative complications after gastrectomy in gastric cancer patients with comorbidities. Surg Today 2016; 46(2): 224–228.
8. Struecker B, Biebl M, Dadras M, Chopra S, Denecke C, Spenke J, Heilmann AC, Bahra M, Sauer IM, Pratschke J, Andreou A. The Impact of Obesity on Outcomes Following Resection for Gastric Cancer. Dig Surg 2017; 34(2): 133–141.
9. Martin AN, Das D, Turrentine FE, Bauer TW, Adams RB, Zaydfudim VM. Morbidity and Mortality After Gastrectomy: Identification of Modifiable Risk Factors. J Gastrointest Surg. 2016; 20(9): 1554–1564.
10. Jung KH, Kim SM, Choi MG, Lee JH, Noh JH, Sohn TS, Bae JM, Kim S. Preoperative smoking cessation can reduce postoperative complications in gastric cancer surgery. Gastric Cancer 2015; 18(4): 683–690.
11. Stratilatovas E., Baušys A., Baušys R., Sangaila E. Mortality after gastrectomy: a 10 year single institution experience. Acta Chir Belg. 2015; 115(2): 123–130.
12. Nakagawa M, Kojima K, Inokuchi M, Kato K, Sugita H, Otsuki S, Sugihara K. Identification of frequency, severity and risk factors of complications after open gastrectomy: Retrospective analysis of prospectively collected database using the Clavien-Dindo classification. J Med Dent Sci. 2016; 63(2–3): 53–59.
13. Simonsen C, de Heer P, Bjerre ED, Suetta C, Hojman P, Pedersen BK, Svendsen LB, Christensen JF. Sarcopenia and Postoperative Complication Risk in Gastrointestinal Surgical Oncology: A Meta-analysis. Ann Surg. 2018; 268(1): 58–69.
14. Zhou CJ, Zhang FM, Zhang FY, Yu Z, Chen XL, Shen X, Zhuang CL, Chen XX. Sarcopenia: a new predictor of postoperative complications for elderly gastric cancer patients who underwent radical gastrectomy. J Surg Res. 2017; 211: 137–146.
15. Zhuang CL, Huang DD, Pang WY, Zhou CJ, Wang SL, Lou N, Ma LL, Yu Z, Shen X. Sarcopenia is an Independent Predictor of Severe Postoperative Complications and Long-Term Survival After Radical Gastrectomy for Gastric Cancer: Analysis from a Large-Scale Cohort. Medicine 2016; 95(13): e3164.
16. Huang DD, Zhou CJ, Wang SL, Mao ST, Zhou XY, Lou N, Zhang Z, Yu Z, Shen X, Zhuang CL. Impact of different sarcopenia stages on the postoperative outcomes after radical gastrectomy for gastric cancer. Surgery 2017; 161(3): 680–693.
17. Beuran M, Tache C, Ciubotaru C, Vartic M, Hostiuc S, Prodan A, Sartelli M, Griffiths EA, Hernandez M, Negoi I. Sarcopenia is a Predictive Factor for Postoperative Morbidity and Mortality in Patients Having Radical Gastrectomy for Cancer. Chirurgia 2018; 113(5): 678–686.
18. Cruz-Jentoft AJ, Baeyens JP, Bauer JM, Boirie Y, Cederholm T, Landi F, Martin FC, Michel JP, Rolland Y, Schneider SM, Topinková E, Vandewoude M, Zamboni M; European Working Group on Sarcopenia in Older People. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing 2010; 39(4): 412–423.
19. Cruz-Jentoft AJ, Sayer AA. Sarcopenia. Lancet Lond Engl. 2019; 393(10191): 2636–2646.
20. Yamamoto K, Hirao M, Nishikawa K, Omori T, Yanagimoto Y, Shinno N, Sugimura K, Miyata H, Wada H, Takahashi H, Yasui M, Ohue M, Yano M, Fujitani K, Tsujinaka T. Sarcopenia Is Associated With Impaired Overall Survival After Gastrectomy for Elderly Gastric Cancer. Anticancer Res. 2019; 39(8): 4297–4303.
21. Kuwada K, Kuroda S, Kikuchi S, Yoshida R, Nishizaki M, Kagawa S, Fujiwara T. Clinical Impact of Sarcopenia on Gastric Cancer. Anticancer Res. 2019; 39(5): 2241–2249.
22. Lee JS, Kim YS, Kim EY, Jin W. Prognostic significance of CT-determined sarcopenia in patients with advanced gastric cancer. PLoS One 2018; 13(8): e0202700.
23. Morley JE, Abbatecola AM, Argiles JM, Baracos V, Bauer J, Bhasin S, Cederholm T, Coats AJ, Cummings SR, Evans WJ, Fearon K, Ferrucci L, Fielding RA, Guralnik JM, Harris TB, Inui A, Kalantar-Zadeh K, Kirwan BA, Mantovani G, Muscaritoli M, Newman AB, Rossi-Fanelli F, Rosano GM, Roubenoff R, Schambelan M, Sokol GH, Storer TW, Vellas B, von Haehling S, Yeh SS, Anker SD; Society on Sarcopenia, Cachexia and Wasting Disorders Trialist Workshop. Sarcopenia with limited mobility: an international consensus. J Am Med Dir Assoc. 2011; 12(6): 403–409.
24. Malmstrom TK, Miller DK, Simonsick EM, Ferrucci L, Morley JE. SARC-F: a symptom score to predict persons with sarcopenia at risk for poor functional outcomes. J Cachexia Sarcopenia Muscle 2016; 7(1): 28–36.
25. Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyère O, Cederholm T, Cooper C, Landi F, Rolland Y, Sayer AA, Schneider SM, Sieber CC, Topinkova E, Vandewoude M, Visser M, Zamboni M; Writing Group for the European Working Group on Sarcopenia in Older People 2 (EWGSOP2), and the Extended Group for EWGSOP2. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing 2019; 48(1): 16–31.
26. Lee K, Shin Y, Huh J, Sung YS, Lee IS, Yoon KH, Kim KW. Recent Issues on Body Composition Imaging for Sarcopenia Evaluation. Korean J Radiol. 2019; 20(2): 205–217.
27. Rinninella E, Cintoni M, Raoul P, Pozzo C, Strippoli A, Bria E, Tortora G, Gasbarrini A, Mele MC. Muscle mass, assessed at diagnosis by L3-CT scan as a prognostic marker of clinical outcomes in patients with gastric cancer: A systematic review and meta-analysis. Clin Nutr. 2019.
28. Chan MY, Chok KSH. Sarcopenia in pancreatic cancer – effects on surgical outcomes and chemotherapy. World J Gastrointest Oncol. 2019; 11(7): 527–537.
29. Amini N, Spolverato G, Gupta R, Margonis GA, Kim Y, Wagner D, Rezaee N, Weiss MJ, Wolfgang CL, Makary MM, Kamel IR, Pawlik TM. Impact Total Psoas Volume on Short- and Long-Term Outcomes in Patients Undergoing Curative Resection for Pancreatic Adenocarcinoma: a New Tool to Assess Sarcopenia. J Gastrointest Surg 2015; 19(9): 1593–1602.
30. Stringer HJ, Wilson D. The Role of Ultrasound as a Diagnostic Tool for Sarcopenia. J Frailty Aging 2018; 7(4): 258–261.
31. Marzetti E, Calvani R, Tosato M, Cesari M, Di Bari M, Cherubini A, Collamati A, D’Angelo E, Pahor M, Bernabei R, Landi F; SPRINTT Consortium. Sarcopenia: an overview. Aging Clin Exp Res. 2017; 29(1): 11–17.
32. Rooks D, Praestgaard J, Hariry S, Laurent D, Petricoul O, Perry RG, Lach-Trifilieff E, Roubenoff R. Treatment of Sarcopenia with Bimagrumab: Results from a Phase II, Randomized, Controlled, Proof-of-Concept Study. J Am Geriatr Soc. 2017; 65(9): 1988–1995.
33. Landi F, Onder G, Bernabei R. Sarcopenia and Diabetes: Two Sides of the Same Coin. J Am Med Dir Assoc. 2013; 14(8): 540–541.
34. Baušys A., Maneikytė J., Strupas K., Šakalienė I. Priešoperacinė reabilitacija abdominalinėje onkologinėje chirurgijoje: naujas paciento paruošimo operacijai standartas? Liet Chir. 2019; 18(2): 73–77.