Lietuvos chirurgija ISSN 1392–0995 eISSN 1648–9942
2020, vol. 19(3–4), pp. 120–127 DOI: https://doi.org/10.15388/LietChirur.2020.19.31
Minimaliai invazyvi chirurgija ir sarginio limfmazgio biopsija – šiuolaikinis lokaliai neišplitusio endometriumo vėžio gydymo standartas: literatūros apžvalga ir Nacionalinio vėžio instituto patirtis
Rūta Čiurlienė
Onkoginekologijos skyrius, Nacionalinis vėžio institutas, Vilnius, Lietuva
Oncogynecology Department, National Cancer Institute, Vilnius, Lithuania
El. paštas ruta.ciurliene@nvi.lt
Diana Žilovič
Onkoginekologijos skyrius, Nacionalinis vėžio institutas, Vilnius, Lietuva
Oncogynecology Department, National Cancer Institute, Vilnius, Lithuania
Biomokslų institutas, Vilniaus universiteto Gyvybės mokslų centras, Vilnius, Lietuva
Institute of Biosciences, Life Sciences Center, Vilnius University, Vilnius, Lithuania
El. paštas diana.zilovic@nvi.lt
Karolina Eva Romeikienė
Vilniaus universiteto Medicinos fakultetas, Vilnius, Lietuva
Faculty of Medicine, Vilnius University, Vilnius, Lithuania
Onkoginekologijos skyrius, Nacionalinis vėžio institutas, Vilnius, Lietuva
Oncogynecology Department, National Cancer Institute, Vilnius, Lithuania
El. paštas eva.romeikiene@gmail.com
Evelina Šidlovska
Valstybinis patologijos centras, Vilnius, Lietuva
National Center of Pathology, Vilnius, Lithuania
El. paštas evelina.sidlovska@vpc.lt
Santrauka. Sarginio limfmazgio biopsija – saugus ir efektyvus endometriumo vėžio gydymo metodas, taikytinas už gimdos ribų neišplitusios ligos atvejais. Tikslas. Išsiaiškinti pacienčių, kurioms diagnozuotas mažos rizikos endometriumo vėžys, sarginio limfmazgio nustatymo dažnį, palyginti minimaliai invazyvios chirurgijos su sarginio limfmazgio biopsija ir atvirųjų operacijų su sistemine dubens limfonodektomija komplikacijų dažnį, operacijų trukmę, lovadienių skaičių ir metodų jautrumą, nustatant metastazes limfmazgiuose. Tyrimo metodai. Atlikta retrospektyvioji ligos istorijų analizė. Tiriamąją imtį sudarė mažos rizikos endometriumo vėžiu sergančios pacientės (n = 103), gydytos Nacionaliniame vėžio institute nuo 2018 m. spalio mėn. iki 2019 m. gruodžio mėn. Tiriamosios suskirstytos į dvi grupes: I grupės pacientėms atlikta laparoskopinė histerektomija ir sarginio limfmazgio biopsija (n = 35); II grupės pacientėms – atviroji histerektomija ir sisteminė dubens limfonodektomija (n = 68). Abi grupės, palyginus jų klinikines ir patologines charakteristikas, buvo tolygios. Rezultatai. Sarginis limfmazgis nustatytas 97,1 proc. pacienčių. Sarginis limfmazgis abiejose dubens pusėse identifikuotas 85,7 proc. atvejų. Sritiniuose limfmazgiuose metastazių nustatyta dviem I grupės pacientėms (5,7 %), II grupėje – nenustatyta. Pooperacinės komplikacijos I grupėje sudarė 3,8 proc., II grupėje – 13 proc.
Išvados. Pacientėms, kurioms diagnozuotas mažos rizikos endometriumo vėžys, taikant endoskopinę chirurgiją ir sarginio limfmazgio biopsiją, nustatoma statistiškai reikšmingai mažiau pooperacinių komplikacijų. Analizuojant Nacionaliniame vėžio institute gydytų pacienčių duomenis, pastebėtas didesnis kalbamojo chirurginio metodo jautrumas nustatant metastazes limfmazgiuose.
Reikšminiai žodžiai: gimdos kūno vėžys, sarginio limfmazgio biopsija, dubens limfonodektomija.
Minimally Invasive Surgery and Sentinel Lymph Node Biopsy – a Modern Standart of Uterine Confined Endometrial Cancer Treatment: Reviewing Literature and Presenting the National Cancer Institute Experience
Abstract. Objectives. To find out sentinel lymph node detection rate of low-risk endometrial cancer patients. To compare postoperative complications rate, lenght of a surgery, lenght of hospital stay and sensitivity of detecting lymph node metastasis between minimally invasive surgery with sentinel lymph node biopsy and abdominal surgery with systemic pelvic lymphadenectomy. Methods. Retrospective analysis of low-risk endometrial cancer patients, treated in National Cancer Institute (n = 103) history cases from 2018 10 untill 2019 12. I group – laparoscopic hysterectomy with sentinel lymph node biopsy (n = 35); II group – abdominal hysterectomy with systemic pelvic lymphadenectomy (n = 68). Both groups were homogeneous according to clinicopathological features. Results. Sentinel lymph node were detected in 97.1% cases. Sentinel lymph nodes in both sides were detected in 85.7% cases. Metastasis in regional lymph nodes were detected in 2 cases (5.7%) in group I and none group II. Postoperative complications rate in group I were 3.8% and 13% in group II. Conclusions. There are significantly less postoperative complications in endoscopic surgery with sentinel node biopsy for low-risk endometrial cancer treatment, also this method is more accurate in surgical staging in National Cancer Institute.
Key words: endometrial cancer, sentinel lymph node biopsy, pelvic lymphadenectomy.
Received: 2020/09/05. Accepted: 2020/07/30.
Copyright © 2020 Rūta Čiurlienė, Diana Žilovič, Karolina Eva Romeikienė, Evelina Šidlovska. Published by Vilnius University Press. This is an Open Access article distributed under the terms of the Creative Commons Attribution Licence, which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Įvadas
Endometriumo vėžys (EV) užima šeštą vietą iš dažniausiai pasaulyje diagnozuojamų piktybinių navikų. Du trečdaliai visų diagnozuotų atvejų nustatomi aukšto ekonominio išsivystymo šalyse Europoje, Šiaurės Amerikoje. Epidemiologinių tyrimų duomenimis, šiose šalyse EV dažnis pastaruosius dešimt metų augo ir prognozuojama, kad augs toliau [1]. Minėtina, kad didelė dalis EV atvejų nustatomi esant ankstyvajai ligos stadijai. Lietuvoje kasmet nustatoma apie 580 naujų EV atvejų, iš jų 70 proc. – I–II stadijos (pagal FIGO). I stadijos penkerių metų išgyvenamumo rodikliai siekia apie 90 proc. [1–3].
Siekiant ligonių išgyvenamumo gerų rezultatų, labai svarbu tikslus ligos stadijos nustatymas ir tinkamas gydymas, tačiau „tinkamas“ reiškia ir „išsaugantis kuo geresnę gyvenimo kokybę“ [1, 4, 5]. Pagrindinis gydymas yra operacinis, tačiau kokios operacijos apimtys turėtų būti pasirinktos sergant už gimdos ribų neišplitusiu EV (angl. uterine-confined (UC)), yra kontroversiškas klausimas. Svarbiausi ligos atkryčio rizikos veiksniai: naviko histologinis tipas, diferenciacijos laipsnis, naviko dydis, įaugimo į miometriumą gylis, limfovaskulinė invazija bei plitimas sritiniuose limfmazgiuose [4, 6, 7].
Daug metų, siekiant nustatyti stadiją chirurginiu būdu, buvo atliekama histerektomija kartu su sistemine limfonodektomija. Tačiau sisteminė limfonodektomija siejama su didesniu pooperacinių komplikacijų, tokių kaip pooperacinės žaizdos infekcija, komplikuotos limfocistos susiformavimas, kojų limfedema, skaičiumi, be to, ji nepagerina ligonių išgyvenamumo rodiklių [5, 7–9]. 2011 m. ir 2017 m. atlikti atsitiktinių imčių klinikiniai tyrimai, kuriuose lygintos dvi grupės moterų, sergančių UC EV: vienai grupei atlikta histerektomija su sistemine dubens limfonodektomija, kitai grupei – tik histerektomija. Sisteminė limfonodektomija nepagerino ligonių bendrojo išgyvenamumo ir nepailgino laiko iki ligos atkryčio [10, 11].
Ligos atkryčio tikimybė sritiniuose limfmazgiuose, nepriklausomai, ar limfonodektomija buvo atlikta, ar ne, nėra didelė (1 lentelė). Remiantis ESMO (angl. European Society For Medical Oncology), ESGO (angl. European Society of Gynaecological Oncology) ir ESTRO (angl. European Society for Radiotherapy and Oncology) jungtinės konferencijos, skirtos EV gairėms aptarti, rekomendacijomis, limfonodektomija neturėtų būti atliekama mažos rizikos EV ligonėms (diferenciacijos laipsnis – G1, G2, invazija į miometriumą – <50 %) [12]. Tačiau iki operacijos atliekamo klinikinio moters ištyrimo duomenys, kaip ir intraoperacinis naviko rizikos įvertinimas, nėra pakankamai tikslūs. Kliniškai nustatyta ankstyvoji gimdos vėžio stadija po operacijos tikslinama 16–22 proc. atvejų (keičiama į didesnę). Priešoperacinės endometro biopsijos nesutapimų su galutiniu histologiniu tyrimu pasitaiko 15–27 proc. atvejų [9, 13].
1 lentelė. Endometriumo vėžio metastazių vieta ligos atkryčio atveju (žr. P. Panici su bendraautoriais (2008) atliktą randomizuotą klinikinį tyrimą „Sisteminė dubens limfonodektomija ar jokios limfonodektomijos gydant ankstyvosios stadijos (pT1) endometriumo vėžį“)
|
Metastazių nustatymo vieta |
Atlikta sisteminė |
Sisteminė limfonodektomija |
|
Ligos atkryčio nėra |
231 (87,5 %) |
217 (86,8 %) |
|
Ligos atkrytis nustatytas |
34 (12,9 %) |
33 (13,2 %) |
|
Plaučiai |
8 (3 %) |
8 (3,2 %) |
|
Pilvaplėvė |
8 (3 %) |
7 (2,8 %) |
|
Makštis |
7 (2,6 %) |
6 (2,4 %) |
|
Limfmazgiai |
4 (1,5 %) |
4 (1,6 %) |
|
Kaulai |
4 (1,5 %) |
3 (1,2 %) |
|
Kepenys |
2 (0,7 %) |
3 (1,2 %) |
|
Nėra duomenų |
3 (1,1 %) |
3 (1,2 %) |
Rizikai vertinti mėginta pritaikyti skubios intraoperacinės biopsijos metodą, tačiau nesutapimai su galutiniu histologiniu tyrimu, įvairių klinikinių tyrimų duomenimis, siekia 5–35 proc. S. Kumaras su bendraautoriais [14] palygino intraoperacinės biopsijos ir galutinio histologinio tyrimo rezultatus: 35 proc. pasikeitė diferenciacijos laipsnis, 28 proc. nustatyta invazija į miometriumą, 13 proc. – plitimas gimdos kaklelyje, 32 proc. – limfovaskulinė invazija.
Kasdienėje klinikinėje EV gydymo praktikoje atvirąsias operacijas pastaraisiais dešimtmečiais keičia minimaliai invazyvi chirurgija. Klinikinis atsitiktinių imčių tyrimas LACE, įtraukiantis 760 EV pacienčių, palygino atvirąsias operacijas su laparoskopinėmis. 4,5 m. išgyvenamumas be ligos atkryčio nustatytas atitinkamai 81,3 proc. ir 81,6 proc. [15]. Kitas randomizuotas klinikinis tyrimas (n = 283) laparoskopijos grupėje nustatė trumpesnį hospitalizacijos laiką, mažesnį pooperacinį analgetikų poreikį, greitesnį sugrįžimą į kasdienę veiklą [10].
Dabar rekomenduojamas ypač selektyvus ir labiau tausojantis chirurginis stadijos nustatymo metodas – sarginio limfmazgio (SL) identifikavimas ir pagilintas jo histologinis ištyrimas [5, 8, 9]. SL – tai limfmazgis, į kurį pirmiausia patenka metastatinės ląstelės iš naviko. Mokslinėje literatūroje nurodoma, kad jeigu šiame limfmazgyje naviko ląstelių neaptinkama, 91–98 proc. atvejų naviko plitimo nebus ir kituose sritiniuose limfmazgiuose. SL žymėti dažniausiai naudojamas fluorescencinis dažas – indocianino žaliasis (ICG). Suleidus šio dažo į gimdos kaklelį ir naudojant artimą infraraudoniesiems spinduliams vaizdo technologiją, stebimas SL švytėjimas. Palyginti su kitomis žymėjimo technikomis, ICG pasižymi mažiausiu komplikacijų dažniu ir didžiausiu SL nustatymo jautrumu sergant endometriumo vėžiu [5, 16, 17].
FIRES (angl. Imaging for Robotic Endometrial Sentinel lymph node biopsy) – vienas didžiausių perspektyviųjų klinikinių tyrimų – nagrinėjo SL biopsijos jautrumą ir neigiamą predikcinę vertę mažos rizikos EV atvejais. Tyrime dalyvavo 10 onkologines pacientes gydančių centrų. Į tyrimą įtrauktos 385 moterys, 340 iš jų taikytas SL žymėjimas naudojant ICG ir sisteminė limfonodektomija (195 atvejais kartu su paraaortine limfonodektomija). Sėkmingu sarginio limfmazgio žymėjimu laikyta, kai bent vienoje dubens pusėje buvo matyti fluorescuojantis limfmazgis ir limfagyslė, nueinanti gimdos kaklelio link. SL identifikuotas 86 proc. atvejų (n = 293). Metastazavimas į sritinius limfmazgius nustatytas 41 pacientei, iš jų bent vienoje dubens pusėje SL sėkmingai identifikuotas 36 moterims. Remiantis SL tyrimu, ligos stadija teisingai nustatyta 35 pacientėms. Vienu atveju, kai SL buvo neigiamas, metastazių nustatyta kituose sritiniuose limfmazgiuose. Remiantis šio klinikinio tyrimo duomenimis, neigiama SL ištyrimo predikcinė reikšmė yra 99,6 proc., o metodo jautrumas, vertinant metastazes limfmazgiuose, – 97,2 proc. Rizika, kad, atliekant sarginio limfmazgio ištyrimą, ligos išplitimas už gimdos ribų bus nenustatytas (klaidingai neigiamas tyrimas), yra kiek mažesnė negu 3 proc. [18].
Ar šį metodą galima taikyti didelės rizikos UC EV (G3, >50 proc. invazija į miometriumą, >2 cm dydžio navikas) ligonėms? Naujausi klinikiniai tyrimai pateikia daug žadančius rezultatus, kad SL gali tapti alternatyva sisteminei limfonodektomijai. Klinikinio tyrimo SHREC (angl. pelvic Sentinel lymph node detection in High-Risk Endometrial cancer) vykdytojai SL žymėjimą naudojant ICG atliko didelės rizikos I–II stadijos endometriumo vėžiu sergančioms pacientėms. Pašalinus SL, atlikta dubens ir infrarenalinė paraaortinė limfonodektomija. Į tyrimą buvo įtrauktos 257 moterys. Metastazių dubens limfmazgiuose nustatyta 54 pacientėms, teisingai pagal SL-ICG algoritmą identifikuota 52. Dviem atvejais metastazių nustatyta išskirtinai paraaortiniuose limfmazgiuose. SL-ICG algoritmo jautrumas siekė 98 proc., o neigiama prognostinė vertė – 99,5 proc. SL abiejose dubens pusėse identifikuotas 95 proc. pacienčių [19].
Kitas SL-ICG metodo privalumas – SL patikslinti taikomas pagilintas histologinis ištyrimas (angl. Ultrastaging). Jis leidžia nustatyti 5–15 proc. daugiau mestastazių negu taikant įprastinį limfmazgių tyrimą, kuris atliekamas limfmazgį per išilginę ašį pjaunant pusiau, tada iš audinių bloko darant vieną pjūvį ir dažant hematoksilinu ir eozinu (HE) [20–21]. Kol kas nėra vienos ultrastaging metodikos, todėl patologijos centruose taikomi metodai gali skirtis, tačiau visur atliekami papildomi, nuoseklūs limfmazgio audinių bloko pjūviai kas 50–250 μm. Preparatai dažomi HE metodu. Jeigu įtariama esant izoliuotų naviko ląstelių, papildomai gali būti taikomi imunohistocheminio dažymo metodai navikui patvirtinti. Įprastai naudojami citokeratinai, iš kurių dažniausias pancitokeratinas (PANCK), bet, priklausomai nuo naviko tipo, gali būti naudojami ir kiti žymenys [20–22]. Ligos plitimas limfmazgyje patvirtinamas, kai nustatoma makrometastazių (>2 mm), mikrometastazių (0,2–2 mm) arba izoliuotų naviko ląstelių (≤200 naviko ląstelių arba ≤0,2 mm) [22].
2020 m. NCCN EV gydymo rekomendacijose SL biopsija pateikiama kaip vienas iš saugių ir efektyvių chirurginio EV gydymo variantų, esant mažos ir didelės rizikos UC atvejams, išskyrus sarkomas. SL identifikavimo sėkmė labai priklauso nuo įstaigoje taikomo algoritmo, chirurgo ir visos operacinės komandos patirties. Šis metodas turėtų būti taikomas centruose, kurie turi daugiausia patirties atliekant tokio tipo operacijas [23].
Tyrimo medžiaga ir metodai
Retrospektyviai išanalizuotos Nacionaliniame vėžio institute (NVI), Onkoginekologijos skyriuje nuo 2018 m. spalio mėn. iki 2019 m. gruodžio mėn. gydytų moterų, kurioms kliniškai ir radiologiškai nustatytas mažos rizikos EV, ligos istorijos bei šių pacienčių duomenys iš informacinių „Elektroninė ligos istorija“ ir Valstybinio patologijos centro sistemų. Į tyrimą įtrauktos 103 moterys, tiriamuoju laikotarpiu operuotos NVI, kurioms iki operacijos, remiantis radiologiniu ir pirminiu histologiniu ištyrimu, nustatyti rT1N0M0 navikai bei G1–G2, endometrioidinė karcinoma. Tiriamosios suskirstytos į dvi grupes: I grupės pacientėms atlikta laparoskopinė histerektomija su SL biopsija (n = 35), II grupės pacientėms – atviroji (abdominalinė) histerektomija su sistemine dubens limfonodektomija (n = 68). SL nustatyti taikytas Memorial Sloan Kettering SL-ICG algoritmas (1 pav.). Pooperacinės komplikacijos įvertintos pagal Clavien ir Dindo klasifikaciją.
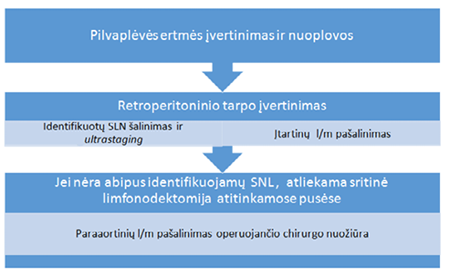
1 pav. Memorial Sloan Kettering SL-ICG algoritmas
Rezultatai
Klinikinės ir patologinės tiriamų grupių charakteristikos pateikiamos 2 lentelėje. SL identifikuotas 34 pacientėms iš 35 (97,1 %). SL abiejose dubens pusėse identifikuotas 30 iš 35 pacienčių (85,7 %). Tiriamųjų, kurioms atlikta sisteminė dubens limfonodektomija, grupėje nė vienai pacientei nebuvo nustatyta metastazių sritiniuose limfmazgiuose, o grupėje, kurioje tirtas SL, metastazių aptikta dviem (5,7 %) pacientėms; jų navikų charakteristika atitiko: pT1aN1M0G1 LVI2 ir pT1bN1M0G1 LVI0. Pacienčių, kurioms tirtas SL, grupėje nustatytas statistiškai reikšmingas (p < 0,05) mažesnis pooperacinių komplikacijų dažnis – 3,8 proc., palyginti su grupe, kuriai buvo atlikta atviroji operacija (13 %) (3 lentelė). Priešoperacinės endometro biopsijos rezultatai nesutapo su galutiniu histologiniu tyrimu (naviko diferenciacijos laipsnis) 28 moterims iš 103 (27 %). Kliniškai nustatyta FIGO I ligos stadija po operacijos pasikeitė į didesnę 9 iš 103 moterų (8,7 %): 4 pacientėms (11,4 %) I grupėje (dvi makrometastazės SL ir dvi dėl lokalaus naviko išplitimo) ir 5 pacientėms (7,3 %) II grupėje (visoms dėl lokalaus naviko išplitimo). Adjuvantinis gydymas I grupėje skirtas 40 proc. (n = 14) atvejų, II grupėje – 30,8 proc. (n = 21) atvejų. Apibendrinant NVI patirtį, galima teigti, kad SL ir minimaliai invazyvi chirurgija turi ryškų pranašumą tiek nustatant metastazes limfmazgiuose, tiek pooperacinių komplikacijų kontekste.
2 lentelė. Klinikinės ir patologinės pacienčių charakteristikos
|
|
I grupė (N; %) |
II grupė (N; %) |
|
Pacienčių skaičius |
35 |
68 |
|
Amžius (vidurkis) |
64 (51–78) |
63,7 (41–83) |
|
KMI |
30,4 |
32,6 |
|
Pooperacinė histologija |
|
|
|
Invazija į miometriumą |
|
|
|
LVI 0 |
27 (77,1) |
56 (82,4 ) |
|
Metastazės limfmazgiuose |
2 (5,7) |
0 |
|
Pašalintų limfmazgių skaičius |
3,3 (1–12) |
11,1 (3–29) |
|
Operacijos trukmė |
162,8 |
130,4 |
|
Lovadienių skaičius |
6,6 |
8,4 |
3 lentelė. Pooperacinių komplikacijų dažnis pagal Clavien ir Dindo skalę
|
Clavien ir Dindo skalė |
I grupė |
II grupė |
|
2a |
– |
Žaizdos infekcija (n = 1) |
|
3a |
Žarnos perforacija (n = 1) |
Komplikuota limfocista (n = 2) |
|
4a |
– |
Miokardo infarktas (n = 1) |
|
Iš viso |
1 |
9 |
Diskusija
Endoskopinė chirurgija yra pirmo pasirinkimo gydymo metodas gydant UC EV. Remiantis tarptautinėmis onkologų ir onkoginekologų rekomendacijomis, esant UC EV, SL biopsija yra alternatyvus ir tikslus chirurginis stadijos nustatymo būdas. SL biopsija pasižymi mažesniu komplikacijų dažniu negu sisteminė dubens limfonodektomija. Panašius rezultatus atspindi ir 2018–2019 m. NVI operuotų moterų duomenys. Pacienčių, kurioms taikyta SL biopsija, grupėje metastazės buvo nustatytos tiksliau, šalintas būtent tas limfmazgis, į kurį pirmiausia patenka naviko ląstelės (limfmazgiui ištirti taikytas ultrastaging metodas).
Klinikinių tyrimų duomenimis, ultrastaging metodo jautrumo ir specifiškumo rodikliai yra aukšti, tačiau klinikinė mikrometastazių (MM) ir ypač izoliuotų naviko ląstelių (INL) reikšmė bei adjuvantinio gydymo tikslingumas nėra patvirtinti. MM/INL dažniausiai nustatomos kartu su kitais gimdos naviko didelės rizikos faktoriais: gili invazija į miometriumą – 61 proc., limfovaskulinė invazija (LVI) – 19 proc., blogesnis diferenciacijos laipsnis G3 – 20 proc. [20].
S. Clair ir bendraautoriai, atlikę retrospektyviąją 844 pacienčių duomenų analizę, nustatė, kad pacienčių, kurioms nustatyti neigiami limfmazgiai, trejų metų išgyvenamumas be ligos atkryčio siekia 90 proc. (INL – 86 proc., MM – 86 proc., makrometastazių – 71 proc.). Daugumai INL turinčių pacienčių (86 %) buvo skirtas adjuvantinis gydymas [24].
M. Plante ir bendraautoriai į perspektyvųjį tyrimą įtraukė 519 moterų. Šio tyrimo duomenimis, pacienčių, kurioms nustatyti neigiami limfmazgiai, trejų metų išgyvenamumas be ligos atkryčio siekė 87,6 proc. (INL – 95,5 proc., MM – 86,5 proc., makrometastazių – 58,6 proc.). Trečdaliui INL turinčių pacienčių (32 %) didelės rizikos faktorių pirminiame navike nenustatyta, adjuvantinis gydymas neskirtas; jų trejų metų išgyvenamumas be ligos atkryčio buvo 100 proc. Autorių nuomone, esant INL, adjuvantinis gydymas turėtų būti parenkamas atsižvelgiant išimtinai į gimdos auglio rizikos faktorius [25].
2018 m. F. J. Backes ir bendraautorių atliktoje metaanalizėje, apėmusioje 175 INL atvejus, nurodoma, kad 43 proc. moterų buvo skirta chemoterapija. Tai buvo pacientės, kurioms nustatyta gili invazija į miometriumą, LVI, blogai diferencijuoti navikai. Įvertinus ligos stadiją, LVI ir naviko diferenciacijos laipsnį, daroma išvada, kad chemoterapija neturėjo įtakos ligos atkryčio dažniui. INL turinčioms pacientėms, kai yra FIGO I–II stadija, endometriodinė karcinoma, atkryčio rizika žema – 4,6 proc., nepriklausomai, ar buvo skirtas adjuvantinis gydymas, ar pacientė tik stebėta [26].
N. R. Gómez-Hidalgo ir bendraautorių atliktoje metaanalizėje, apimančioje 2 873 EV atvejus, INL/MM konstatuotos 17 proc. pacienčių. Lygintos dvi grupės: I grupę sudarė pacientės, kurioms nustatytos INL/MM, adjuvantinis gydymas neskirtas, II grupę sudarė pacientės, kurioms nustatyti neigiami limfmazgiai arba kurioms nustatytos INL/MM ir skirtas adjuvantinis gydymas. Ligos atkryčio rizika buvo vienoda abiejose grupėse [27].
Daroma išvada, kad pacientės, kurioms nustatoma INL/MM, turi didesnę ligos atkryčio riziką negu turinčiosios neigiamus limfmazgius, tačiau nėra patvirtinta, kad adjuvantinis gydymas šią riziką sumažintų. Tikima, kad greitu metu didelių imčių randomizuoti kontroliuojami klinikiniai tyrimai pateiks patvirtintas rekomendacijas dėl minėtais atvejais skirtino adjuvantinio gydymo [24–26, 28].
Literatūra
1. Lortet-Tieulent J, Ferlay J, Bray F, Jemal A. International Patterns and Trends in Endometrial Cancer Incidence, 1978–2013. Journal of the National Cancer Institute 2018; 110(4): 354–361.
2. Atalay F, Cetinkaya K, Bacinoglu A. Is the 2009 FIGO staging system really valuable for stage I endometrial cancer? European Journal of Gynaecological Oncology 2013; 34(6): 556–558.
3. Vilniaus universiteto Onkologijos instituto Vėžio kontrolės ir profilaktikos centras, Vėžio registras. Vėžys Lietuvoje 2009 metais. Vilnius: Vilniaus universiteto Onkologijos institutas, 2011. Prieiga internete: <https://www.nvi.lt/uploads/pdf/Vezio%20registras/Vezys_lietuvoje_2009.pdf>.
4. Cancer report 2018. Cancer of the corpus uteri. FIGO. Available at: <https://www.figo.org/news/cancer-corpus-uteri-0016166>.
5. Devaja O. Sentinel Lymph Node Biopsy in Endometrial Cancer. Scientific Impact Paper 2016; 51. Available at: <https://www.rcog.org.uk/globalassets/documents/guidelines/scientific-impact-papers/sip_51.pdf>.
6. Creasman W. Revised FIGO staging for carcinoma of the endometrium. International Journal of Gynaecology and Obstetrics 2009; 105(2): 109.
7. Atalay F, Cetinkaya K, Bacinoglu A. Risk Factors of Lymph Node Metastases with Endometrial Carcinoma. Asian Pacific Journal of Cancer Prevention 2014; 15(15): 6353–6356.
8. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Uterine Neoplasms. NCCN Guidelines Version 12018 Panel Members Uterine Neoplasms 2018.
9. Kitchener H, Swart AMC, Qian Q, Amos C, Parmar MKB, ASTEC study group. Efficacy of systemic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC trial): a randomised study. Lancet 2009; 373(9658): 125–136.
10. Mourits MJE, Bijen CB, Arts HJ, ter Brugge HG, van der Sijde R, Paulsen L, Wijma J, Bongers MY, Post WJ, van der Zee AG, de Bock GH. Safety of laparoscopy versus laparotomy in early-stage endometrial cancer: a randomised trial. The Lancet Oncology 2010; 11(8): 763–771. DOI: 10.1016/s1470-2045(10)70143-1.
11. Neubauer NL, Lurain JR. The role of lymphadenectomy in surgical staging of endometrial cancer. International Journal of Surgical Oncology 2011; 2011: 814649.
12. Panici PB, Basile S, Falco CD, Lissoni AA, Signorelli M, Giannarelli D. Response: Systematic Pelvic Lymphadenectomy vs No Lymphadenectomy in Early-Stage Endometrial Carcinoma: Randomized Clinical Trial. JNCI Journal of the National Cancer Institute.
13. Barton DP, Naik R, Herod J. Efficacy of systematic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC Trial): a randomized study. International Journal of Gynecological Cancer 2009; 19(8): 1465.
14. Kumar S, Bandyopadhyay S, Semaan A, Shah JP, Mahdi H, Morris R, Munkarah A, Ali-Fehmi R. The Role of Frozen Section in Surgical Staging of Low Risk Endometrial Cancer. PLoS ONE 2011; 6.
15. Janda M, Gebski V, Davies LC, Forder P, Brand A, Hogg R, Jobling TW, Land R, Manolitsas T, Nascimento M, Neesham D, Nicklin JL, Oehler MK, Otton G, Perrin L, Salfinger S, Hammond I, Leung Y, Sykes P, Ngan H, Garrett A, Laney M, Ng TY, Tam K, Chan K, Wrede CD, Pather S, Simcock B, Farrell R, Robertson G, Walker G, Armfield NR, Graves N, McCartney AJ, Obermair A. Effect of Total Laparoscopic Hysterectomy vs Total Abdominal Hysterectomy on Disease–Free Survival Among Women With Stage I Endometrial Cancer: A Randomized Clinical Trial. JAMA 2017; 317(12): 1224–1233.
16. Frost JA, Webster KE, Bryant A, Morrison J. Lymphadenectomy for the management of endometrial cancer. The Cochrane Database of Systematic Reviews 2017; 2017(10): CD007585.
17. Bedyńska M, Szewczyk G, Klepacka T, Sachadel K, Maciejewski T, Szukiewicz D, Fijałkowska A. Sentinel lymph node mapping using indocyanine green in patients with uterine and cervical neoplasms: restrictions of the method. Archives of Gynecology and Obstetrics 2019; 299(5): 1373–1384.
18. Rossi EC, Kowalski LD, Scalici J, Cantrell L, Schuler K, Hanna RK, Method M, Ade M, Ivanova A, Boggess JF. A comparison of sentinel lymph node biopsy to lymphadenectomy for endometrial cancer staging (FIRES trial): a multicentre, prospective, cohort study. The Lancet Oncology 2017; 18(3): 384–392. DOI: 10.1016/s1470-2045(17)30068-2.
19. Persson J, Salehi S, Bollino M, Lönnerfors C, Falconer H, Geppert B. Pelvic Sentinel lymph node detection in High-Risk Endometrial Cancer (SHREC-trial) – the final step towards a paradigm shift in surgical staging. European Journal of Cancer 2019; 116: 77–85. DOI: 10.1016/j.ejca.2019.04.025
20. Koskas M, Chereau E, Ballester M, Dubernard G, Lécuru F, Heitz D, Mathevet P, Marret H, Querleu D, Golfier F, Leblanc E, Luton D, Rouzier R, Daraï E. Accuracy of a nomogram for prediction of lymph-node metastasis detected with conventional histopathology and ultrastaging in endometrial cancer. British Journal of Cancer 2013; 108(6): 1267–1272. DOI: 10.1038/bjc.2013.95.
21. Euscher E, Sui D, Soliman P, Westin S, Ramalingam P, Bassett R, Malpica A. Ultrastaging of Sentinel Lymph Nodes in Endometrial Carcinoma According to Use of 2 Different Methods. International Journal of Gynecological Pathology 2018; 37(3): 242–251.
22. Mueller JJ, Nobre SP, Braxton K, Alektiar KM, Leitao MM, Aghajanian C, Ellenson LH, Abu-Rustum NR. Incidence of pelvic lymph node metastasis using modern FIGO staging and sentinel lymph node mapping with ultrastaging in surgically staged patients with endometrioid and serous endometrial carcinoma. Gynecologic Oncology 2020; 157(3): 619–623. DOI: 10.1016/j.ygyno.2020.03.025.
23. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Uterine Neoplasms. NCCN Guidelines Version 12020 Panel Members Uterine Neoplasms 2020.
24. Clair CMS, Eriksson AGZ, Ducie JA, Jewell EL, Alektiar KM, Hensley ML, Soslow RA, Abu-Rustum NR, Leitao MM. Low-Volume Lymph Node Metastasis Discovered During Sentinel Lymph Node Mapping for Endometrial Carcinoma. Ann Surg Oncol 2016; 23(5): 1653–1659.
25. Plante M, Stanleigh J, Renaud MC, Sebastianelli A, Grondin K, Grégoire J. Isolated tumor cells identified by sentinel lymph node mapping in endometrial cancer: Does adjuvant treatment matter? Gynecologic Oncology 2017; 146(2): 240–246. DOI: 10.1016/j.ygyno.2017.05.024.
26. Kim CH, Soslow RA, Park KJ, Barber EL, Khoury-Collado F, Barlin JN, Sonoda Y, Hensley ML, Barakat RR, Abu-Rustum NR. Pathologic ultrastaging improves micrometastasis detection in sentinel lymph nodes during endometrial cancer staging. International Journal of Gynecologic Cancer 2013; 23(5): 964–970.
27. Gómez-Hidalgo NR, Ramirez PT, Ngo B, Pérez-Hoyos S, Coreas N, Sanchez-Iglesias JL, Cabrera S, Franco S, Benavente AP, Gil-Moreno A. Oncologic impact of micrometastases or isolated tumor cells in sentinel lymph nodes of patients with endometrial cancer: a meta-analysis. Clin Transl Oncol 2020; 22(8): 1272–1279.
28. Backes FJ, Felix AS, Grégoire J, Plante M, Sullivan SA, Rossi EC, Tanner III EJ, Stewart KI, Soliman PT, Cohen D, Holloway RW, Abu-Rustum NR, Leitao MM. Sentinel lymph node (SLN) isolated tumor cells (ITCs) in otherwise stage I/II endometrioid endometrial cancer: To treat or not to treat? Gynecologic Oncology 2018; 149(1): 7–8.