Lietuvos chirurgija ISSN 1392–0995 eISSN 1648–9942
2025, vol. 24(4), pp. 305–315 DOI: https://doi.org/10.15388/LietChirur.2025.24(4).7
Gimdos lygiųjų raumenų neaiškaus piktybinio potencialo navikas: klinikinis atvejis ir literatūros apžvalga
Kotryna Narkutė
Vilniaus universitetas, Medicinos fakultetas, Vilnius, Lietuva
Vilnius University, Faculty of Medicine, Vilnius, Lithuania
El. paštas kotryna.narkute@mf.stud.vu.lt
https://orcid.org/0009-0007-2055-0631
https://ror.org/03nadee84
Evelina Šidlovska
Vilniaus universiteto ligoninė Santaros klinikos, Valstybinis patologijos centras, Vilnius, Lietuva
Vilnius University Hospital Santaros Klinikos, National Center of Pathology, Vilnius, Lithuania
El. paštas evelina.sidlovska@vpc.lt
Diana Bužinskienė
Vilniaus universitetas, Medicinos fakultetas, Klinikinės medicinos institutas, Akušerijos ir ginekologijos klinika, Vilnius, Lietuva
Vilnius University, Faculty of Medicine, Institute of Clinical Medicine, Clinic of Obstetrics and Gynaecology, Vilnius, Lithuania
El. paštas diana.buzinskiene@mf.vu.lt
https://orcid.org/0000-0002-4522-0600
https://ror.org/03nadee84
Santrauka. Gimdos lygiųjų raumenų navikai įprastai skirstomi į gerybinius ir piktybinius. PSO klasifikacijoje išskiriama dar viena – tarpinė – gimdos lygiųjų raumenų navikų grupė, vadinama gimdos lygiųjų raumenų neaiškaus piktybinio potencialo navikais. Tai reti navikai, turintys kai kurių piktybiškumo požymių, tačiau nevisiškai atitinkantys lejomiosarkomų diagnostikos kriterijus. 71 m. pacientei dėl skausmo kairėje apatinėje pilvo dalyje paskirta gydytojo akušerio-ginekologo konsultacija. Atlikus magnetinio rezonanso tomografijos tyrimą, nustatytas heterogeniškos struktūros, nelygiais kraštais, 10x11,5 cm dydžio navikas, pagal radiologinius požymius primenantis lejomiosarkomą. Pacientei atlikta totalinė histerektomija ir abipusė salpingoovarektomija. Histologinio tyrimo metu nustatyta atipinių koaguliacinio tipo nekrozių, tačiau kitų piktybiškumo požymių nerasta. Atmetus lejomiosarkomą, diagnozuotas gimdos lygiųjų raumenų neaiškaus piktybinio potencialo navikas. Dėl galimo naviko recidyvavimo pacientei skirtas intensyvus stebėjimas. Po 8 mėn. pacientė atvyko konsultacijos dėl skausmo apatinėje pilvo dalyje, tačiau, atlikus viso kūno kompiuterinę tomografiją, naviko recidyvo požymių nerasta. Pacientei rekomenduota tolesnė stebėsena kas 12 mėn. Tarptautinių diagnostikos ir gydymo gairių šiam navikui nėra. Totalinė histerektomija kartu su abipuse salpingoovarektomija šiandien laikytina pirmo pasirinkimo gydymo metodu pacientėms po menopauzės. Dėl galimo naviko recidyvo (iki 20 proc. atvejų) pacientės turi būti atidžiai stebimos.
Reikšminiai žodžiai: gimdos lygiųjų raumenų neaiškaus piktybinio potencialo navikas, STUMP, gimdos lygiųjų raumenų navikai, ginekologinė onkologija, chirurginis gydymas.
Uterine Smooth Muscle Tumor of Uncertain Malignant Potential: Case Report and Literature Review
Abstract. Uterine smooth muscle tumors are usually classified as benign or malignant. According to the WHO, there is another group of intermediate neoplasms, known as uterine smooth muscle tumors of uncertain malignant potential. These are rare tumors that display some characteristics of malignancy, but do not fully meet the criteria of leiomyosarcoma. A 71-year-old female with complaints of left-sided abdominal pain was referred to a gynecologist. MRI revealed a heterogenous, ill-defined large mass (10x11,5 cm) with radiologic findings suggestive of leiomyosarcoma. The patient underwent total hysterectomy with bilateral salpingo-oophorectomy. Histological examination revealed only atypical coagulative necrosis with no other signs of malignancy, excluding leiomyosarcoma and leading to the diagnosis of STUMP. Given the possibility of recurrence, close follow-up was recommended. Eight months later, the patient came for a check-up with complaints of lower abdominal pain. A whole-body CT scan was performed, but no signs of tumor recurrence were found. The patient was advised to continue monitoring every 12 months. There are no internationally accepted guidelines for diagnosing and treating of these neoplasms. Total hysterectomy with bilateral salpingo-oophorectomy is considered the most effective surgical treatment for women who are postmenopausal. Given the tumor’s potential to recur as either STUMP or leiomyosarcoma, with a recurrence rate of up to 20%, close follow-up is crucial.
Keywords: uterine smooth muscle tumor of uncertain malignant potential, STUMP, uterine smooth muscle tumors, gynecologic oncology, surgical treatment.
Received: 2025-01-14. Accepted: 2025-05-29.
Copyright © 2025 Kotryna Narkutė, Evelina Šidlovska, Diana Bužinskienė. Published by Vilnius University Press. This is an Open Access article distributed under the terms of the Creative Commons Attribution Licence, which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Įvadas
Gimdos lygiųjų raumenų dariniai ‒ dažniausi ginekologinės kilmės navikai, nustatomi iki 75 proc. moterų [1]. Įprastai šie navikai skirstomi į gerybinius (gimdos lejomiomos) ir piktybinius (gimdos lejomiosarkomos) [2]. Tobulėjant diagnostikos metodams ir siekiant tiksliau diferencijuoti navikus, 1973 m. Kempsonas [3] išskyrė ir aprašė dar vieną grupę gimdos lygiųjų raumenų navikų, pasižyminčių tarpinėmis savybėmis tarp gerybinių ir piktybinių darinių. 1994 m. Bellas ir kt. [4] sukūrė diagnostinius Stanfordo kriterijus, kuriais iki šiol vadovaujamasi atliekant šių navikų histologinę diagnostiką. Taikytini trys pagrindiniai požymiai: ląstelių atipija, koaguliacinė nekrozė ir mitozinis aktyvumas. Navikai klasifikuojami kaip gimdos lygiųjų raumenų neaiškaus piktybinio potencialo navikai (angl. uterine smooth muscle tumor of uncertain malignant potential, STUMP). Tai reti navikai, turintys lejomiosarkomoms būdingų piktybiškumo požymių, dėl kurių negali būti vertinami kaip gerybiniai dariniai, tačiau neatitinkantys visų lejomiosarkomos diagnostinių kriterijų [2, 5].
STUMP bendrųjų diagnostikos ir gydymo gairių iki šiol nėra, todėl diagnostika ir gydymas vis dar kelia nemažai iššūkių. Kadangi minėti navikai reti, pasigendama išsamesnės informacijos, o mokslinėje literatūroje pristatomi tik nedidelės apimties tyrimai [5, 6]. Diagnozuojant šiuos navikus svarbūs tiek radiologiniai tyrimai prieš operacinį gydymą, tiek tiksli histologinė diagnostika po atliktos operacijos, todėl nagrinėjama tema aktuali ne tik gydytojams akušeriams-ginekologams, bet ir radiologijos bei patologijos sričių specialistams.
Straipsnio tikslas – aprašyti diagnozuoto gimdos lygiųjų raumenų neaiškaus piktybinio potencialo naviko klinikinį atvejį ir apžvelgti mokslinę literatūrą apie šio naviko diagnostiką ir gydymą, recidyvų rizikos veiksnius bei stebėjimo dėl recidyvų svarbą.
Klinikinis atvejis
71 m. pacientė 2023 m. sausio mėn. atvyko gydytojo akušerio-ginekologo konsultacijos dėl įtariamos gimdos lejomiosarkomos. Pacientė skundėsi maudimu kairėje apatinėje pilvo dalyje. Moteris ‒ po menopauzės (menopauzė trunka apie 30 metų), kraujavimo iš gimdos po menopauzės nebuvo. Gimdžiusi vieną kartą natūraliais takais, atlikti trys nėštumo nutraukimai. Ginekologinėmis ligomis pacientė nesirgusi, ginekologinių operacijų neturėjusi, gimdos kaklelio citologinis tyrimas (PAP tepinėlis) neatliktas.
Atlikus ginekologinę apžiūrą nustatyta, kad gimda palpuojant padidėjusi ir nelygi, gimdos priedai atskirai neišpalpuoti. Transvaginalinio ultragarsinio tyrimo metu gimdos kūno projekcijoje rastas didelių matmenų mišrios echostruktūros darinys, turintis kraujotaką. Darinio dydis ‒ 9,84×11,38 cm. Gimda ir kiaušidės atskirai nevizualizuotos, laisvo skysčio ar papildomų darinių mažajame dubenyje nenustatyta (1 ir 2 pav.).
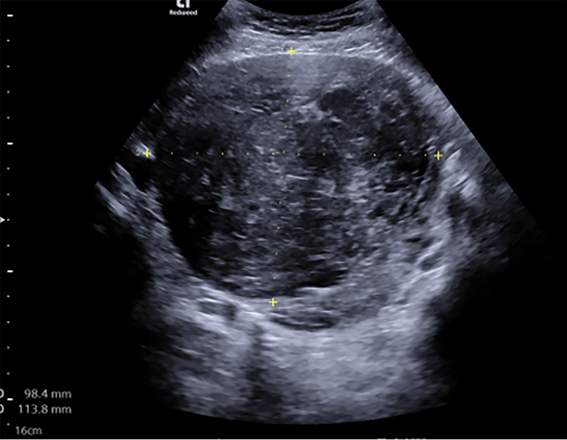
1 pav. Transvaginalinio ultragarsinio tyrimo metu gimdoje rastas mišrios echostruktūros darinys
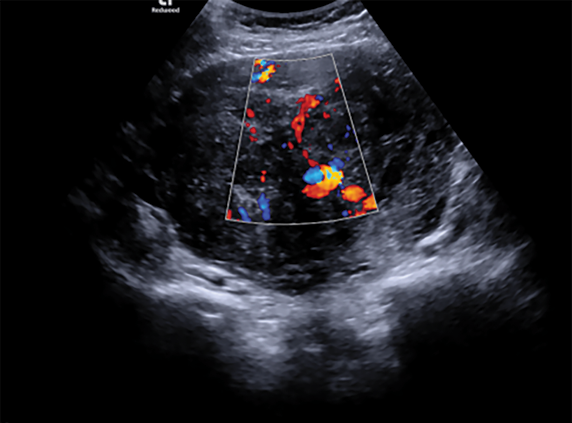
2 pav. Gimdos darinio kraujotakos vizualizacija, pritaikius spalvinę doplerografiją
Diagnozei patikslinti nuspręsta atlikti dubens magnetinio rezonanso tomografijos (MRT) tyrimą. MRT metu gimdos priekinėje sienoje pastebėtas didelių matmenų (10x11,5 cm), neaiškių ribų, heterogeniškos struktūros intramuralinis darinys, T2 sekoje – vidutinio intensyvumo signalo, pasižymintis centrinėje dalyje esančiomis nekrozinėmis zonomis ir hemoraginiais intarpais. Skenuojant po intraveninio kontrastavimo, buvo matyti, kad darinys vaskuliarus, kaupia kontrastinę medžiagą, nekrozės srityse turi vaskuliarių struktūrų, ADC signalas izointensinis miometriumui (1,06×10‒3 mm2/s). Gimdos ertmė dėl darinio suspausta ir deformuota, jos kontūrai sunkiai diferencijuojami. Laisvo skysčio pilvaplėvės ertmėje nenustatyta. MRT tyrimo išvada – darinys gimdos kūne, tikėtina, yra lejomiosarkoma (3 pav.).
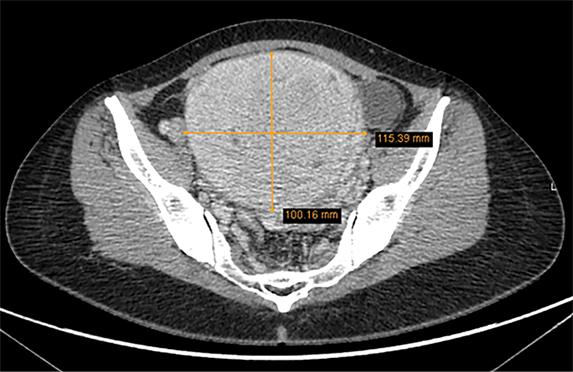
3 pav. Dubens magnetinio rezonanso tomografija, atlikta diagnozei patikslinti ir gydymo taktikai parinkti
1 lentelė. Naviko imunohistocheminio dažymo rezultatai
|
Imunohistocheminis žymuo |
Gautas rezultatas |
|---|---|
|
ER |
++, branduolio reakcija 95 % |
|
SMA |
+++, citoplazminė reakcija 100 % |
|
DES |
++/+++, citoplazminė reakcija 90 % |
|
CALDDES |
++/+++, citoplazminė reakcija 90 % |
|
Ki67 |
proliferacinis aktyvumas 2‒3 %, |
|
P53 |
+, heterogeniška reakcija (nemutavusi) |
|
CD10 |
++, citoplazminė reakcija 70 % |
Pacientei rekomenduotas operacinis gydymas – laparatomija, totalinė histerektomija ir abipusė salpingoovarektomija. Operacijos metu gimda buvo padidėjusi (atitiko 12–14 nėštumo savaičių dydį), joje buvo matyti miomų mazgai. Didžiausias mazgas nustatytas priekinėje gimdos sienoje. Gimdos prieduose abipus matomų pakitimų nepastebėta. Pilvaplėvėje ir taukinėje patologijų taip pat nenustatyta. Gimda ir abiejų pusių gimdos priedai išsiųsti histologiniam tyrimui atlikti, siekiant patvirtinti diagnozę.
Atlikus histologinį tyrimą, nustatytas gimdos kūno miometre plintantis ląstelingas navikas, suformuotas persipinančių lygiųjų miocitų pluoštų. Navike pastebėta iki 4 mitozių 10 DPRL (didelio padidinimo regėjimo lauke). Buvo matyti atipinės koaguliacinio tipo nekrozės (4 pav.). Limfovaskulinio plitimo neidentifikuota, navikas aiškiai demarkuotas nuo aplinkinio miometro. Navikas imunohistochemiškai nudažytas (1 lentelė). Galutinė patologijos diagnozė ‒ gimdos lygiųjų raumenų neaiškaus piktybinio potencialo navikas (STUMP). Dėl netipinio augimo ir atipinių nekrozių darinys priskirtas neaiškaus piktybinio potencialo lygiųjų miocitų navikų grupei. Aiškių piktybiškumo požymių (branduolių polimorfizmo, didelio mitozinio aktyvumo ar aukšto proliferacinio indekso ar limfovaskulinio plitimo) neidentifikuota. Tikslinga tolesnė pacientės stebėsena kas 6–12 mėn.
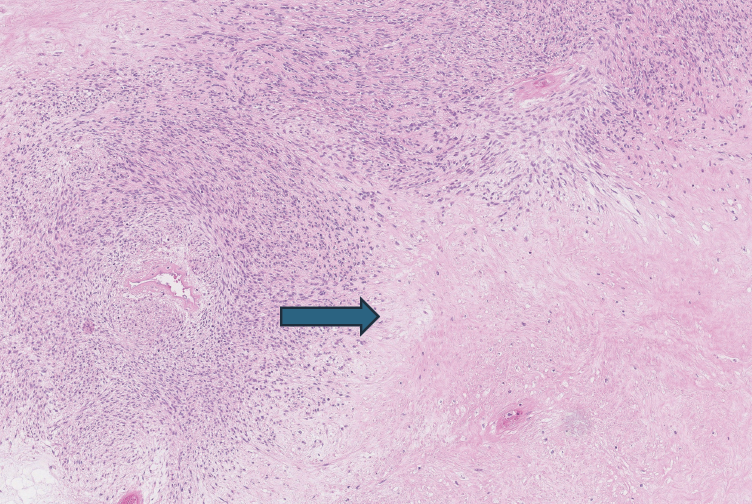
4 pav. Koaguliacinio tipo nekrozė (pažymėta rodykle) histologiniame preparate (H&E dažymas, padidinimas ×10)
Kadangi aiškaus piktybinio potencialo gimdos navike nenustatyta, atlikus radikaliąją operaciją, adjuvantinė terapija netaikyta.
Praėjus 10 mėn. po operacijos, pacientė atvyko į pirmąją pooperacinę gydytojo ginekologo apžiūrą (vykdoma stebėsena). Moteris skundėsi maudimu apatinėje pilvo dalyje ir retkarčiais atsirandančiu trumpu, diegiančio pobūdžio pilvo skausmu. Atlikus transvaginalinę echoskopiją, laisvo skysčio ar papildomų darinių mažajame dubenyje nepastebėta. Dėl minėtų skundų ir galimo navikinio proceso atsinaujinimo ar išplitimo į gretimus organus pacientei rekomenduota atlikti kaklo, krūtinės ląstos, pilvo ir dubens organų kompiuterinę tomografiją, naudojant kontrastinę medžiagą. Atlikus vaizdinius tyrimus, naviko recidyvo ar progresavimo požymių nerasta. Pacientei rekomenduota pakartotinė gydytojo ginekologo konsultacija po vienų metų.
Dar po metų pacientė atvyko į antrąją pooperacinę gydytojo ginekologo konsultaciją (vykdoma stebėsena). Moteris jautė maudimą apatinėje pilvo dalyje. Kraujavimo iš genitalijų ar šlapinimosi sutrikimų pacientė nepastebėjo. Siekiant stebėti galimą gimdos naviko recidyvą, nuspręsta atlikti kaklo, krūtinės, pilvo ir dubens organų kompiuterinę tomografiją, naudojant kontrastinę medžiagą. Atlikus tyrimą, naviko recidyvo ar progresavimo požymių nenustatyta. Pacientei rekomenduota pakartotinė gydytojo akušerio-ginekologo konsultacija po 12 mėn.
Diskusija
Dėl naviko reto paplitimo ir nevienodų diagnostikos kriterijų tikslus STUMP paplitimas nėra žinomas. Nustatyta, kad iš visų histerektomijų ar miomektomijų, atliekamų dėl lejomiomos, pooperacinė STUMP diagnozė sudaro 0,01 proc. atvejų [7]. Gimdos lygiųjų raumenų neaiškaus piktybinio potencialo navikai dažniau nustatomi moterims perimenopauzės laikotarpiu ar po menopauzės, vidutinis pacienčių amžius ‒ nuo 40 iki 50 metų [8, 9]. Pacienčių, kurioms diagnozuotas STUMP, amžius, sisteminių apžvalgų duomenimis, varijuoja nuo 18 iki 75 metų [10]. Rizikos veiksniai, turintys įtakos STUMP formavimuisi, šiuo metu nežinomi [6, 11, 12].
STUMP klinikine simptomatika nesiskiria nuo kitų gimdos lygiųjų raumenų navikų. Būdingas patologinis kraujavimas iš gimdos, ilgas ar gausus menstruacinis kraujavimas, gausaus kraujavimo sąlygota lėtinė anemija, dismenorėja (skausmingos menstruacijos), pilvo skausmai, spaudimas į gretimus organus ir su juo susiję simptomai (priklausomai nuo darinio dydžio ir lokalizacijos). Esant didesniems navikams, galima apčiuopti darinį pilve [4, 11, 13].
Vienas iš didžiausių STUMP diagnostikos iššūkių ‒ taikant skirtingus vaizdinimo metodus nustatyti tikėtiną darinio piktybinį potencialą, nes tai lemia gydymo taktiką ir padeda prognozuoti ligos eigą. Pirminiam ištyrimui ginekologijoje dažniausiai taikoma ultrasonografija [14]. Atliekant ultragarsinę diagnostiką, STUMP požymiai panašesni į lejomiosarkomų, o ne į lejomiomų [15]. Dažniausiai nustatomas vienas, didelio diametro, netaisyklingos formos, pakitusios miometriumo struktūros darinys, neturintis akustinio šešėlio. Taip pat pastebimas endometriumo sustorėjimas [14, 16]. Minėtina, kad STUMP, palyginti su gerybiniais gimdos lygiųjų raumenų dariniais, būdingesnis heterogeniškas echogeniškumas [16]. Mokslinėje literatūroje [17] teigiama, kad ultragarsinės diagnostikos metu gimdoje nustatytas darinys, turintis smulkių cistinių struktūrų ir vaskuliarizacijos pokyčių (tiek darinyje, tiek aplink jį), leidžia įtarti STUMP. Dauguma tyrėjų sutaria, kad pacientėms, kurioms ultragarsinio tyrimo metu nustatomi neaiškūs gimdos dariniai, turėtų būti atliekama išsamesnė radiologinė diagnostika. Dažniausiai pasirenkama atlikti dubens magnetinio rezonanso tomografiją (MRT), retesniais atvejais – pozitronų emisijos tomografiją (PET) [4, 14, 18].
Pagrindinis MRT diagnostikos privalumas – gera minkštųjų audinių skiriamoji geba, todėl šis metodas dažniausiai taikomas, kai ultragarsinio tyrimo metu nustatoma įtartinų gimdos naviko požymių (heterogeniškas echogeniškumas, vaskuliarizacija, cistiniai dariniai, didelė darinio apimtis) ir siekiant dar prieš operaciją įvertinti naviko piktybiškumo tikimybę bei parinkti tinkamą operacinio gydymo taktiką [4, 19]. Galimai piktybinį darinį leidžia įtarti tam tikrų požymių visuma: vienas didesnės apimties navikas, neaiškiomis ribomis, pasižymintis vidutinio ar aukšto intensyvumo signalais T1 ir T2 sekose, cistiniai pokyčiai darinyje [14, 19]. Gimdos navikams diagnozuoti MRT atliekama naudojant kontrastinę medžiagą ‒ gadolinį [19]. Piktybiniai gimdos dariniai ir STUMP įprastai nehomogeniškai kaupia kontrastinę medžiagą. Siekiant rasti efektyvią alternatyvą, kaip diferencijuoti gimdos lygiųjų raumenų darinius nenaudojant kontrastinės medžiagos, pradėta taikyti speciali difuzijos restrikcijos (angl. diffusion-weighted imaging, DWI) seka [19]. Taikant DWI, lejomiosarkomų ir STUMP atvejais pastebimas stiprus DWI signalo intensyvumas, o apskaičiuoto tariamojo koeficiento (angl. apparent diffusion coefficient, ADC) vertė yra žemesnė, negu nustatant gerybinius darinius. Taigi navikas, pasižymintis stipriu DWI signalu ir žema ADC verte, gali būti vertinamas kaip neaiškaus piktybinio potencialo arba galimai piktybinis. DWI sekos ir ADC verčių derinys diagnostiniu tikslumu atitinka MRT, taikant intraveninį kontrastavimą [19].
Nepaisant sparčios technologijų raidos ir šių technologijų pritaikymo medicinoje, svarbiausiu ir patikimiausiu gimdos lygiųjų raumenų navikų diagnostikos metodu išlieka navikų histologinė morfologija [20]. Atliekant pooperacinę histologinę diagnostiką, įprastai vadovaujamasi trimis pagrindiniais kriterijais: citologine atipija, mitozių skaičiumi ir naviko ląstelių koaguliacine nekroze [9, 21]. 2014 m. Pasaulio sveikatos organizacijos (PSO) patvirtintoje Moterų genitalijų navikų klasifikacijoje STUMP apibūdinami kaip dariniai, neatitinkantys lejomiomoms keliamų kriterijų, bet pasižymintys patologiniais požymiais, būdingais lejomiosarkomai, todėl galintys turėti piktybinį potencialą [7, 9]. STUMP diagnozė dažniausiai patvirtinama atmetus galimas lejomiomos ir lejomiosarkomos diagnozes [22]. Naujausioje 2020 m. PSO Moterų genitalijų navikų klasifikacijoje STUMP priskirti tarpinei (angl. intermediate) gimdos lygiųjų raumenų navikų grupei [23]. Taigi, taikant Stanfordo kriterijus ir PSO rekomenduojamą apibrėžimą, STUMP gali būti diagnozuojami šiais atvejais: 1) navikas, pasižymintis židinine vidutine ar sunkia daugiažidine citologine atipija, nesant naviko ląstelių nekrozės ir ≤10 mitozių 10 DPRL (didelio padidinimo regėjimo lauke); 2) navikas, pasižymintis vidutine ar sunkia difuzine citologine atipija ir ≤10 mitozių 10 DPRL; 3) navikas, kuriam būdinga koaguliacinė ląstelių nekrozė, nesant citologinės atipijos arba esant nedidelei citologinei atipijai bei ≤10 mitozių 10 DPRL; 4) navikas, pasižymintis ≥15 mitozių 10 DPRL, nesant naviko ląstelių nekrozės ar citologinės atipijos [7].
Standartizuotų gydymo gairių, skirtų STUMP, nėra. Šiems navikams gydyti reikia individualaus gydymo plano, nes gydymo taktikos pasirinkimas priklauso nuo daugelio veiksnių, pavyzdžiui, nuo moters amžiaus, reprodukcinių nuostatų, ikioperacinio pacientės įvertinimo, gydytojo patirties [5]. Mokslinėje literatūroje daugiausia pagrįstų duomenų pateikiama apie chirurginio gydymo pritaikymą. STUMP operacinis gydymas dažniausiai skirstomas į mažesnės apimties operacijas, kai atliekamos miomektomijos, ir į didesnės apimties, t. y. radikaliąsias operacijas, kai atliekamos histerektomijos, kartu šalinant gimdos priedus, arba atliekama tik histerektomija.
Vienas iš galimų operacijos metodų ‒ gimdą tausojančios procedūros, t. y. miomektomijos, kurių metu pašalinamas tik įtartinas gimdos darinys, tausojant gimdą ir taip išsaugant moters vaisingumą [24]. Šis metodas dažniausiai taikomas negimdžiusioms moterims, planuojančioms ateityje pastoti, tačiau visada svarbu įvertinti galimybes naviką pašalinti radikaliai ir informuoti pacientę apie rizikas, susijusias su šia procedūra [25]. Pagrindinė rizika ‒ didesnė recidyvų tikimybė dėl galimai nevisiškos naviko ekscizijos, nors, tyrimų duomenimis, statistiškai reikšmingo skirtumo tarp pacienčių, kurioms atliktos miomektomijos ir histerektomijos, grupių, skaičiuojant recidyvų dažnį, nenustatyta. Jaunesnio amžiaus moterims, planuojančioms ateityje gimdyti, gana saugus ir klinikinėje praktikoje dažnai taikomas gydymo būdas ‒ atlikti miomektomiją, o vėliau, įgyvendinus reprodukcinius planus, atlikti histerektomiją, siekiant kuo labiau sumažinti ligos atkryčio ir progresavimo tikimybę [26]. Pacientėms, kurios nebeplanuoja nėštumo, ar esant menopauzei standartinis rekomenduojamas gydymas ‒ histerektomija. Aiškių duomenų dėl kiaušidžių šalinimo nėra [3], tačiau gimdos priedai dažniau šalinami vyresnio amžiaus moterims. Histerektomijai atlikti gali būti taikomos įvairios taktikos: tiek laparotominė, tiek laparoskopinė histerektomija, priklausomai nuo gimdos ir joje esančių darinių dydžio [5].
Dėl neapibrėžto naviko piktybinio potencialo išlieka ligos recidyvų ir atokių metastazių rizika, todėl pacientes būtina informuoti, kad svarbu periodiškai lankytis pas gydytoją akušerį-ginekologą dėl stebėsenos [7, 8]. Sutariama, kad STUMP atveju pacientes reikia stebėti intensyviai, nes ligai būdingi ir vėlyvieji recidyvai, pasireiškiantys nuo ligos pradžios praėjus daugiau negu 5 metams [11]. Dauguma tyrėjų [6, 11, 12] nurodo, kad, nustačius ligą ir pritaikius gydymą, pacientes reikėtų stebėti bent 10 metų: pirmuosius 5 metus – kas 6 mėnesius, likusius 5 metus – kas 12 mėnesių. Kai kuriuose mokslo darbuose [6] siūloma vertinti bendrąją pacienčių, kurioms atlikta histerektomija, klinikinę būklę ir simptomus kas pusę metų, o kartą per metus atlikti viso kūno kompiuterinės tomografijos (KT) tyrimą. Kituose darbuose [3, 8] rekomenduojama kas pusę metų atlikti ginekologinę apžiūrą ir dubens organų ultragarsinį tyrimą, o kartą per metus ‒ krūtinės ląstos rentgenografiją, pilvo organų ultragarsinį tyrimą, pilvo KT ar MRT. Pasireiškus įtarimą keliantiems, neaiškiems simptomams, galima atlikti reikiamos srities KT, magnetinio rezonanso tomografiją (MRT) ar net pozitronų emisijos tomografiją su kompiuterine tomografija (PET/KT), priklausomai nuo prieinamų diagnostikos galimybių ir pacientės klinikinių simptomų [11].
Nepaisant to, kad neaiškaus piktybinio potencialo gimdos lygiųjų raumenų navikams būdinga santykinai gera prognozė, galimi jų recidyvai [5, 12]. Mokslinėje literatūroje pateikiami duomenys apie STUMP recidyvų dažnį skiriasi. Galima manyti, kad tai sietina su mažu naviko paplitimu, nedideliu tyrimuose dalyvaujančių pacienčių skaičiumi ir po gydymo atliekamos stebėsenos ypatumais (pavyzdžiui, pacientės neatvyksta vizito arba stebėsena vykdoma kitose gydymo įstaigose). Nustatyta, kad naviko recidyvų dažnis siekia 8–20 proc., tačiau yra tyrimų, kuriuose nurodomas didesnis recidyvų dažnis (iki 36,4 proc. atvejų) [13]. Nustačius pirminę diagnozę, STUMP vidutiniškai recidyvuoja po 51 mėn., tačiau mokslinėje literatūroje aprašyta atvejų, kai recidyvas nuo nustatytos pirminės diagnozės pasireiškė 15 mėn.‒9 m. laikotarpiu [27]. Šie duomenys pagrindžia išvadą, kad STUMP atveju pacientes būtina stebėti ilgą laiką. Minėtina, kad STUMP recidyvuoja dažniausiai ta pačia morfologine forma, t. y. recidyvo metu patvirtinama histologinė STUMP diagnozė. Vis dėlto yra duomenų apie galimą piktybinę šių navikų transformaciją recidyvo metu ‒ histologiškai nustatomi įvairios histologinės morfologijos navikai, dažniausiai gimdos lejomiosarkomos [10]. Vietiniai recidyvai dažnesni negu atokiosios metastazės. Jei operacijos metu atlikta miomektomija, naviko židiniai dažniausiai nustatomi pilvaplėvėje ir gimdoje [10]. Sisteminėse apžvalgose ir kituose tyrimuose nurodomos ir atokiosios metastazės, kurių randama plaučiuose, pleuroje, limfmazgiuose, kepenyse, kauluose, galvos ir nugaros smegenyse [9, 11, 17].
Mokslinėje literatūroje daug dėmesio skiriama veiksniams, galintiems didinti naviko recidyvo riziką, nustatyti. Su paciente sietini bendrieji rizikos veiksniai, turintys įtakos navikui atsinaujinti, kol kas nėra žinomi. Tyrimų duomenimis, amžius, nėštumų skaičius, kūno masės indeksas (KMI) ir rūkymas reikšmingos įtakos šios ligos recidyvų dažniui neturi [28]. Sisteminėje apžvalgoje [29] nagrinėjant, kokią įtaką naviko recidyvui daro Stanfordo histologiniai kriterijai, nustatyta, kad didžiausia naviko atsinaujinimo rizika siejama su pažengusia citologine atipija ir koaguliacine ląstelių nekroze. Atliekama ir mokslinių tyrimų, kuriais siekiama nustatyti imunohistocheminius rodiklius, galinčius parodyti naviko polinkį į piktybiškumą bei recidyvus. Patikimiausiais ir kliniškai pagrįstais laikomi p53, p16 ir Ki-67 ekspresijos pokyčiai [1, 30]. Tyrimais nustatyta, kad Ki-67 indeksas, siekiantis 20 proc. ir daugiau, siejamas su didesne recidyvo rizika. Difuzinė p16 ekspresija taip pat vertinama kaip statistiškai reikšmingas recidyvų rizikos veiksnys. Didesnė recidyvo rizika tikėtina naviko imunohistocheminio tyrimo metu nustačius progesterono receptorių raišką <83 proc. [28]. Mokslinėse studijose dažnai analizuojama, kiek recidyvų rizikai turi įtakos pasirinktas operacijos tipas ir morceliacijos (darinio smulkinimo) taikymas operacijos metu. Retrospekcinių tyrimų ir sisteminės apžvalgos [26, 31] duomenimis, STUMP recidyvų dažnis tiriamųjų, kuriems taikytos miomektomijos ir histerektomijos, grupėse skyrėsi nežymiai, statistiškai reikšmingo skirtumo nenustatyta. Rizikos veiksniu, lemiančiu didesnį recidyvų dažnį, laikoma morceliacija. Taikant morceliaciją (ypač atliekant atvirąją (angl. unprotected) morceliaciją ir nenaudojant specialių apsauginių maišelių), statistiškai dažniau nustatomi vietiniai ligos recidyvai ir atokiosios metastazės [10, 28]. Taigi, įtariant neaiškaus piktybinio potencialo ar piktybinį gimdos lygiųjų raumenų darinį, morceliacijos rekomenduojama vengti [5, 28]. Galima manyti, kad recidyvų dažnis susijęs ir su naviko lokalizacija gimdoje. Retrospekcinės studijos duomenimis [26], naviko recidyvo rizika šalinant subserozinius navikus yra 5,7 karto didesnė, palyginti su intramuraliniais ar submukoziniais gimdos navikais.
Ligos recidyvų gydymas kelia dar daugiau klausimų. Nei pagrindinės ligos, nei recidyvų gydymo bendrųjų gairių nėra, todėl kiekvienu atveju ieškoma individualių sprendimų. Pabrėžtina multidisciplininės gydytojų komandos svarba [32]. Recidyvams dažniausiai taikomas pakartotinis chirurginis gydymas, tačiau mokslinėje literatūroje aprašomi atvejai, kai, atsižvelgiant į recidyvo ar atokiosios metastazės lokalizaciją, taikoma adjuvantinė chemoterapija (pavyzdžiui, cisplatinos, docetakselio, doksorubicino, ifosfamido preparatai, jie derinami tarpusavyje, skiriami keli gydymo kursai) [32–34] ar radioterapija [35]. Trūkstant duomenų apie naviko jautrumą hormonams, hormonoterapija taikoma retai, tačiau literatūroje aprašyta atvejų, kai medroksiprogesteronas, gonadotropiną atpalaiduojančio hormono (GnRH) agonistas ar aromatazės inhibitoriai sėkmingai naudoti gydant pasikartojusią ligą [5, 34].
Išvados
Gimdos lygiųjų raumenų neaiškaus piktybinio potencialo navikai – retai diagnozuojama gimdos navikų grupė, tačiau ją svarbu įtraukti į gimdos lygiųjų raumenų navikų diferencinę diagnostiką, ypač tais atvejais, kai vaizdinių tyrimų duomenys turi specifiškų, gerybiniams dariniams nebūdingų, piktybiškumą galinčių nurodyti požymių. Pagrindinis šių navikų (STUMP) gydymo metodas ‒ radikalusis chirurginis jų pašalinimas. Nors STUMP ilgalaikė prognozė ir pacienčių išgyvenamumas santykinai geri, šie navikai dėl neapibrėžto piktybinio potencialo gali recidyvuoti, todėl, atlikus chirurginį gydymą, būtina nuosekli ir ilgalaikė pacienčių stebėsena.
Autorių indėlis
Kotryna Narkutė ‒ idėjos suformavimas, metodologija, rašymas (pirminis rankraštis), vizualizacija.
Evelina Šidlovska ‒ vizualizacija, vadovavimas moksliniam darbui, validacija.
Diana Bužinskienė ‒ idėjos suformavimas, metodologija, vadovavimas moksliniam darbui, rašymas (pirminio rankraščio peržiūra ir redagavimas).
Author contributions
Kotryna Narkutė ‒ conceptualization, methodology, writing (original draft), visualization.
Evelina Šidlovska ‒ visualization, supervision, validation.
Diana Bužinskienė ‒ conceptualization, methodology, supervision, writing (review and editing).
Literatūra
1. Travaglino A, Raffone A, Gencarelli A, Neola D, Oliviero DA, Alfano R, Campanino MR, Cariati F, Zullo F, Mollo A, Insabato L. p53, p16 and ki67 as immunohistochemical prognostic markers in uterine smooth muscle tumors of uncertain malignant potential (STUMP). Pathol Res Pract 2021; 226: 153592.
2. Ettore C, Incognito GG, Gulino FA, Russo E, Cannone F, Ettore G. Uterine smooth muscle tumor of uncertain malignant potential: a retrospective, monocentric cohort study. Surgeries 2023; 4(3): 412–419.
3. Garg M, Rajanbabu A, Nair IR. Smooth muscle tumors of uncertain malignant potential or atypical leiomyomas: a long-term evaluation of surgical outcomes and clinicopathological features. Eur J Obstet Gynecol Reprod Biol 2024; 301: 201–205.
4. Liu HT, Wong CN, Wong CN, Liu FS. Uterine smooth muscle tumor of uncertain malignant potential: a review of current knowledge. Taiwan J Obstet Gynecol 2022; 61(6): 935–940.
5. Tinelli A, D’Oria O, Civino E, Morciano A, Hashmi AA, Baldini GM, Stefanovic R, Malvasi A, Pecorella G. Smooth muscle tumor of uncertain malignant potential (STUMP): a comprehensive multidisciplinary update. Medicina (Kaunas) 2023; 59(8): 1371.
6. Dall’asta A, Gizzo S, Musarò A, Quaranta M, Noventa M, Migliavacca C, Sozzi G, Monica M, Mautone D, Berretta R. Uterine smooth muscle tumors of uncertain malignant potential (STUMP): pathology, follow-up and recurrence. Int J Clin Exp Pathol 2014; 7(11): 8136–8142.
7. Lapresa-Alcalde MV, Ruiz-Navarro MJ, Sancho de Salas M, Cubo AM. A review and follow-up of uterine smooth muscle tumours of uncertain malignant potential (STUMP): a case series and literature review. Diseases 2023; 11(3): 99.
8. Bucuri CE, Ciortea R, Malutan AM, Oprea V, Toma M, Roman MP, Ormindean CM, Nati I, Suciu V, Mihu D. Smooth muscle tumor of uncertain malignant potential (STUMP): a systematic review of the literature in the last 20 years. Curr Oncol 2024; 31(9): 5242–5254.
9. Gadducci A, Zannoni GF. Uterine smooth muscle tumors of unknown malignant potential: a challenging question. Gynecol Oncol 2019; 154(3): 631–637.
10. Di Giuseppe J, Grelloni C, Giuliani L, Delli Carpini G, Giannella L, Ciavattini A. Recurrence of uterine smooth muscle tumor of uncertain malignant potential: a systematic review of the literature. Cancers 2022; 14(9): 2323.
11. Rizzo A, Ricci AD, Saponara M, Leo ADE, Perrone AM, Iaco PDE, Pantaleo MA, Nannini M. Recurrent uterine smooth-muscle tumors of uncertain malignant potential (STUMP): state of the art. Anticancer Res 2020; 40(3): 1229–1238.
12. Bacanakgil BH, Deveci M, Karabuk E, Soyman Z. Uterine smooth muscle tumor of uncertain malignant potential: clinicopathologic-sonographic characteristics, follow-up and recurrence. World J Oncol 2017; 8(3): 76–80.
13. Pinto A. Uterine smooth muscle tumors: an overview. Adv Anat Pathol 2024; 31(6): 397–410.
14. Bonneau C, Thomassin-Naggara I, Dechoux S, Cortez A, Darai É, Rouzier R. Value of ultrasonography and magnetic resonance imaging for the characterization of uterine mesenchymal tumors. Acta Obstet Gynecol Scand 2014; 93(3): 261–268.
15. Borella F, Mancarella M, Preti M, Mariani L, Stura I, Sciarrone A, Bertschy G, Leuzzi B, Piovano E, Valabrega G, Turinetto M, Pino I, Castellano I, Bertero L, Cassoni P, Cosma S, Franchi D, Benedetto C. Uterine smooth muscle tumors: a multicenter, retrospective, comparative study of clinical and ultrasound features. Int J Gynecol Cancer 2024; 34(2): 244–250.
16. Jeon J, Park J, Lee E, Han J, Kim D, Park J, Kwag M, Yun S, Jung SJ. Prolapsed uterine smooth muscle tumor of uncertain malignant potential: a case report and review of radiologic findings. Curr Med Imaging 2023.
17. Cotrino I, Carosso A, Macchi C, Baima Poma C, Cosma S, Ribotta M, Viora E, Sciarrone A, Borella F, Zola P. Ultrasound and clinical characteristics of uterine smooth muscle tumors of uncertain malignant potential (STUMPs). Eur J Obstet Gynecol Reprod Biol 2020; 251: 167–172.
18. Liu S, Chang J, Su W, Lv H, Xu B, Gong W. Imaging characteristics of uterine smooth muscle tumors of uncertain malignant potential: a case report and literature review. J Int Med Res 2024; 52(9): 3000605241279183.
19. Lin G, Yang LY, Huang YT, Ng KK, Ng SH, Ueng SH, Chao A, Yen TC, Chang TC, Lai CH. Comparison of the diagnostic accuracy of contrast-enhanced MRI and diffusion-weighted MRI in the differentiation between uterine leiomyosarcoma / smooth muscle tumor with uncertain malignant potential and benign leiomyoma. J Magn Reson Imaging 2016; 43(2): 333–342.
20. Momeni-Boroujeni A, Nucci MR, Chapel DB. Risk stratification of uterine smooth muscle tumors: the role of morphology, immunohistochemistry, and molecular testing. Adv Anat Pathol 2025; 32(1): 44–56.
21. Zhang C, Gao J, Lu S, Zhang Y, Zhu H. Uterine smooth muscle tumors of uncertain malignant potential (STUMP): a retrospective study in a single center. Eur J Obstet Gynecol Reprod Biol 2021; 265: 74–79.
22. Zheng YY, Liu XB, Mao YY, Lin MH. Smooth muscle tumor of uncertain malignant potential (STUMP): a clinicopathologic analysis of 26 cases. Int J Clin Exp Pathol 2020; 13(4): 818–826.
23. Choi JH, Ro JY. The 2020 WHO classification of tumors of soft tissue: selected changes and new entities. Adv Anat Pathol 2021; 28(1): 44–58.
24. Richtarova A, Boudova B, Dundr P, Lisa Z, Hlinecka K, Zizka Z, Fruhauf F, Kuzel D, Slama J, Mara M. Uterine smooth muscle tumors with uncertain malignant potential: analysis following fertility-saving procedures. Int J Gynecol Cancer 2023; 33(5): 701–706.
25. Arcieri M, Cianci S, Martinelli C, Parisi S, Pergolizzi S, Capozzi VA, La Verde M, Ronsini C, Restaino S, Vizzielli G, Palmara V, Granese R, Ercoli A. Uterine smooth muscle tumor of uncertain malignant potential (STUMP) treated with conservative surgery: systematic review of reproductive outcomes. Clin Exp Obstet Gynecol 2022; 49(12): 267.
26. Şahin H, Karatas F, Coban G, Özen Ö, Erdem Ö, Onan MA, Ayhan A. Uterine smooth muscle tumor of uncertain malignant potential: fertility and clinical outcomes. J Gynecol Oncol 2019; 30(4): e54.
27. Bosoteanu M, Deacu M, Voda RI, Orasanu CI, Aschie M, Vlad SE, Penciu RC, Chirila SI. Five-year retrospective study of uterine STUMP and leiomyosarcoma. Clin Pract 2022; 12(6): 897–907.
28. Borella F, Cosma S, Ferraioli D, Ray-Coquard I, Chopin N, Meeus P, Cockenpot V, Valabrega G, Scotto G, Turinetto M, Biglia N, Fuso L, Mariani L, Franchi D, Vidal Urbinati AM, Pino I, Bertschy G, Preti M, Benedetto C, Castellano I, Cassoni P, Bertero L. Clinical and histopathological predictors of recurrence in uterine smooth muscle tumor of uncertain malignant potential (STUMP): a multicenter retrospective cohort study of tertiary centers. Ann Surg Oncol 2022; 29(13): 8302–8314.
29. Travaglino A, Raffone A, Gencarelli A, Caldarelli C, Granata M, Santoro A, Zannoni GF, Mollo A, Zullo F, Insabato L. Stanford parameters stratify the risk of recurrence in gynecologic smooth muscle tumors of uncertain malignant potential. Acta Pathol Microbiol Immunol Scand 2021; 129(6): 283–290.
30. Rubisz P, Ciebiera M, Hirnle L, Zgliczyńska M, Łoziński T, Dzięgiel P, Kobierzycki C. The usefulness of immunohistochemistry in the differential diagnosis of lesions originating from the myometrium. Int J Mol Sci 2019; 20(5): 1136.
31. Shim JI, Han AKW, Jeon HJ, Kim ML, Jung YW, Yun BS, Seong SJ, Shin E, Cho YJ, Rha SH. Clinical experience of uterine smooth muscle tumor of uncertain malignant potential in two gynecological centers: oncological and obstetrical aspects. Eur J Obstet Gynecol Reprod Biol 2020; 246: 7–13.
32. Ha HI, Choi MC, Heo JH, Kim KA, Jung SG, Park H, Joo WD, Song SH, Kim TH, Lee C. A clinicopathologic review and obstetric outcome of uterine smooth muscle tumor of uncertain malignant potential (STUMP) in a single institution. Eur J Obstet Gynecol Reprod Biol 2018; 228: 1–5.
33. Basaran D, Usubutun A, Salman MC, Narin MA, Boyraz G, Turkmen O, Kimyon GC, Karalok A, Bulbul D, Turan T, Ozgul N, Yuce K. The clinicopathological study of 21 cases with uterine smooth muscle tumors of uncertain malignant potential: centralized review can purify the diagnosis. Int J Gynecol Cancer 2018; 28(2): 233–240.
34. Ip PPC, Cheung ANY. Pathology of uterine leiomyosarcomas and smooth muscle tumours of uncertain malignant potential. Best Pract Res Clin Obstet Gynaecol 2011; 25(6): 691–704.
35. Gupta M, Laury AL, Nucci MR, Quade BJ. Predictors of adverse outcome in uterine smooth muscle tumours of uncertain malignant potential (STUMP): a clinicopathological analysis of 22 cases with a proposal for the inclusion of additional histological parameters. Histopathology 2018; 73(2): 284–298.